Молекулярная организация миелина
Уникальной особенностью миелина является его формирование в результате спирального обвития отростков глиальных клеток вокруг аксонов, настолько плотного, что между двумя слоями мембраны практически не остается цитоплазмы. Миелин представляет собой эту двойную мембрану, то есть состоит из липидного бислоя и белков, связанных с ним.
Среди белков миелина выделяют так называемые внутренние и внешние белки. Внутренние интегрированы в мембрану, внешние расположены поверхностно, и поэтому связаны с ней слабее. Миелин также содержит гликопротеиды и гликолипиды.
Белки составляют 25—30 % массы сухого вещества миелиновой оболочки нейронов ЦНС млекопитающих. На долю липидов приходится приблизительно 70—75 % от сухой массы. В миелине спинного мозга процент содержания липидов выше, чем в миелине головного. Большую часть липидов составляют фосфолипиды (43 %), остальное — холестерин и галактолипиды в примерно равном соотношении.
Стимуляция миелинизации нейронов помогла восстановить мозг после инсульта
Миелинизирующий олигодендроцит в мозге крысы
Wikimedia Commons
Американским ученым удалось добиться восстановления ткани мозга после инсульта белого вещества у мышей за счет стимуляции миелинизации поврежденных нейронов. Статья опубликована в журнале Proceedings of the National Academy of Sciences
.
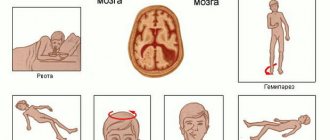
Ишемический инсульт представляет собой острое нарушение мозгового кровоснабжения в результате тромбоза, вызывающее гибель участка его ткани. Выделяют две основные формы ишемического инсульта. При первом типе, вызванном тромбозом крупным артерий мозга, повреждение тканей затрагивает крупные участки мозга, включая и серое, и белое вещество. Второй тип ишемического инсульта вызывается тромбозом мелких артерий и затрагивает только подкорковые участки белого вещества. Со временем, однако, поврежденные участки разрастаются. К такому типу относятся около 25 процентов случаев инсульта. Вероятность такого инсульта повышается с возрастом и после 80 лет становится почти стопроцентной. Такой инсульт является второй по частоте причиной деменции (приобретенного слабоумия). Несмотря на это, способов восстановления ткани мозга после инсульта белого вещества до сих пор не существует.
На первом этапе эксперимента авторы, используя мышиную модель инсульта белого вещества, показали, почему при этом заболевании не происходит восстановления ткани мозга. Инсульт вызывает демиелинизацию аксонов (повреждение их миелиновых оболочек). Это стимулирует нейрогенез: в месте повреждения начинают делиться клетки-предшественницы олигодендроцитов (миелинизирующих клеток нейроглии). При неишемических повреждениях белого вещества (например, при рассеянном склерозе) клетки-предшественницы затем дифференцируются в зрелые олигодендроциты, которые заново миелинизируют поврежденные аксоны, что приводит к частичному восстановлению поврежденной ткани. Однако при инсульте белого вещества клетки-предшественницы олигодендроцитов не дифференцируются в зрелые олигодендроциты, а вместо этого превращаются в астроциты, приводя к глиозу ткани (разрастанию астроцитарной нейроглии).
На втором этапе эксперимента авторы смогли отменить блокаду созревания клеток-предшественниц олигодендроцитов. Для этого они вмешались в работу сигнального пути рецептора белка Nogo (NgR1). Этот белок ингибирует рост аксонов, и в предыдущих исследованиях было показано, что при инсульте в ткани мозга повышается количество лигандов рецептора NgR1, а количество его ингибиторов уменьшается. Оказалось, что введение в поврежденный участок белого вещества антагониста NgR1 снимает блокаду созревания олигодендроцитов: клетки-предшественники начинают активнее созревать и больше не дифференцируются в астроциты. Это приводит к миелинизации поврежденных аксонов и восстановлению ткани. Кроме того, у старых мышей с инсультом такая терапия приводила к заметному восстановлению двигательной активности — даже в тех случаях, когда заболевание уже успело перейти в хроническую форму.
Недавно ученые продемонстрировали способ восстановления ткани мозга после инсульта с помощью профилактики воспаления: оказалось, что антагонисты рецепторов к воспалительному цитокину интерлейкину-1 способствует частичному восстановлению поврежденной ткани у крыс. Ранее ученым удалось добиться восстановления утраченных после инсульта функций с помощью инъекции модифицированных мезенхимальных стволовых клеток в поврежденные области моторной коры.
Софья Долотовская
Миелинизация аксонов
В образовании миелиновой оболочки и структуре миелина ЦНС и периферической нервной системы имеются отличия.
Миелинизация в ЦНС
Обеспечивается олигодендроцитами. Каждый олигодендроглиоцит образует несколько «ножек», каждая из которых оборачивает часть какого-либо аксона. В результате один олигодендроцит связан с несколькими нейронами. Перехваты Ранвье здесь шире, чем на периферии. Согласно исследованию 2011 г. мощную миелиновую изоляцию в мозге получают наиболее активные аксоны, что позволяет им далее работать ещё эффективнее. Важную роль в этом процессе играет сигнализатор глутамат[1][2].
Миелинизация в периферической НС
Обеспечивается Шванновскими клетками. Каждая Шванновская клетка формирует спиральные пластинки миелина и отвечает лишь за отдельный участок миелиновой оболочки отдельного аксона. Цитоплазма Шванновской клетки остается только на внутренней и наружной поверхностях миелиновой оболочки. Между изолирующими клетками также остаются перехваты Ранвье, которые здесь уже, чем в ЦНС.
Так называемые «немиелинизированные» волокна все равно изолированы, но по несколько иной схеме. Несколько аксонов частично погружены в изолирующую клетку, которая не смыкается вокруг них до конца.
Установлено, что поздняя миелинизация нейронов, продолжающаяся у человека даже во взрослом возрасте, сильно отличает его от шимпанзе и других приматов[3].
Белое вещество мозга в первый месяц после рождения ребенка
Микроструктура белого вещества, необходимая для эффективной и скоординированной передачи нейронных импульсов, подвергается особенно явному развитию в первые годы жизни, в то время как отклонения от этой траектории развития мозга, вероятно, приводят к изменениям связей мозга, имеющим отношение к поведению ребенка, а впоследствии и взрослого человека. Оценка микроструктуры белого вещества при нормальном развитии мозга имеет решающее значение для неврологического подхода как к типичному, так и к патологическому раннему развитию.
Результаты исследований выявляют изменения микроструктуры белого вещества в самые ранние периоды развития и демонстрируют разный период развития регионов и региональных асимметрий.
Нейронная архитектура, которая образует пучки миелинизированных нервных волокон, известная как микроструктура белого вещества, имеет фундаментальное значение для связей мозга и способствует формированию когнитивного функционирования более высокого уровня. Развитие структуры (схемы) белого вещества происходит из-за каскада сложных процессов, таких как образование аксонов, дендритное прорастание и миелинизация, которое начинается на поздних стадиях беременности и продолжает развиваться через детство, юность и взрослую жизнь с наиболее выраженным созреванием в течение первых двух лет жизни. В течение этого периода развития субстраты нервной ткани , которые управляют индивидуальными различиями в отношении уязвимости или устойчивости к неблагоприятным воздействиям, вероятно, станут формироваться на самых ранних этапах развития мозга. Несмотря на важность микроструктуры белого вещества для здоровой функции мозга и связности, существенный разрыв остается в наших знаниях относительно нормативных характеристик микроструктуры детского белого вещества, таких как половой диморфизм и асимметрия, особенно в течение недель, следующих сразу после рождения.
Магнитно-резонансная томография (МРТ) предоставляет детальные изображения мозга и может неинвазивно отслеживать изменения, связанные с развитием белого вещества. Диффузионная МРТ (dMRI) очень чувствительна к изменениям микроструктуры тканей и широко используется для изучения волоконной архитектуры белого вещества. Диффузионное тензорное изображение (DTI) обеспечивает измеримые показатели диффузионных характеристик, включая фракционную анизотропию (FA), среднюю диффузию (MD), радиальную диффузию (RD) и осевую диффузию (AD), каждая из которых обеспечивает количественные характеристики диффузии в тканях мозга. Учитывая степень анизотропной диффузии в белом веществе — из-за тканевых барьеров, таких как аксональные волокна и миелиновая оболочка — FA, MD, RD и AD, обеспечивают непрямые маркеры микроструктуры белого вещества.
Более поздние методы dMRI, такие как дисперсия ориентации нейритов и изображение плотности (NODDI ), используют биофизическое моделирование для повышения уровня выявления микроструктурной специфичности, доступной для нейровизуализации. NODDI измеряет количественные параметры трех специфических диффузионных процессов: диффузия интранейритов (ν IC, диффузия внутри аксонов и дендритов), диффузия экстранейрита и изотропная (свободная) диффузия воды (ν ISO). Подобная модель также количественно определяет степень углового изменения нейритов через индекс дисперсии ориентации (ODI). NODDI предоставляет важную информацию о развитии головного мозга у младенцев и детей младшего возраста с изменениями параметров, совместимыми с механизмами нейроразвития миелинизации и развития аксонального волокна в течение первых нескольких лет жизни. Например, нелинейное увеличение объемной доли интранейритов NODDI (ν IC ) происходит примерно в первые 3 года детства , а ν ICпродолжает увеличиваться нелинейно до 7,5 лет. У явно недоношенных детей параметры NODDI указывают на увеличение дисперсии аксонов и более низкую плотность аксонов по сравнению с вовремя родившимися младенцами, и эти параметры также связаны с более слабыми функциональными исходами у очень недоношенных детей. Эти исследования дают ценное представление о профилях развития головного мозга, а также демонстрируют полезность методологии dMRI.
Даже в узком возрастном диапазоне показатели микроструктуры белого вещества варьируются в зависимости от гестационного возраста и проявляются в широких левосторонних различиях. Половые различия минимальны, и между параметрами белого вещества и маркерами роста новорожденных не возникало значительных ассоциаций. Наконец, сравнение значений DTI и NODDI показывает, что, хотя эти методы измеряют аналогичные аспекты микроструктуры белого вещества, они обеспечивают дифференциальную микроструктурную информацию на раннем этапе развития ребенка. Показатели диффузии DTI сильно связаны с возрастом, скорректированным на длительность беременности, что отражает снижение общего содержания воды в мозге и увеличение плотности мембран. RD уменьшается, а FA увеличивается в центральных областях белого вещества, что может свидетельствовать о ранней миелинизации или усиленной организации волокон и пучков белого вещества. Преимущество NODDI заключается в том, что он использует биофизическое моделирование для определения конкретных характеристик микроструктуры. ν IC интерпретируется для обеспечения индекса плотности нейритов (т. е. аксонов и дендритов), тогда как ODI является показателем степени когерентности волокон.
Центральные области белого вещества, такие как мозолистое тело, внутренние капсулы и радиальные лучи, развиваются перед более периферическим белым веществом, а задние отделы развиваются перед более передними, причем, большая часть микроструктуры белого вещества устанавливается через один месяц. Качественно карты FA и ODI в один месяц кажутся взрослыми, что свидетельствует о том, что архитектура волокон и их организация развиваются в матке. С другой стороны, процессы развития, такие как миелинизация, в основном происходят постнатально и, вероятно, влияют на последующие изменения параметров RD и ν IC
Примечания
- Попов, Леонид
Биологи раскрыли секрет миелинизации аксонов. membrana.ru (11 августа 2011). Проверено 11 августа 2011. Архивировано 15 февраля 2012 года. - Hiroaki Wake, Philip R. Lee, R. Douglas Fields.
Control of Local Protein Synthesis and Initial Events in Myelination by Action Potentials. Science (4 August 2011). Проверено 11 августа 2011. Архивировано 15 февраля 2012 года. - Способности к обучению связали с электрической изоляцией нейронов