Этиология и патогенез
Заболевание наследуется по аутосомно-рецессивному типу. В основе его, по-видимому, лежит врожденное нарушение обмена веществ, но первичный биохимический дефект еще не выявлен. Оба пола заболевают одинаково часто. С. Н. Давиденков (1936) считал, что сложная картина Миоклонус-эпилепсии является выражением своеобразного плейотропизма гена этой болезни. Родители больных Миоклонус-эпилепсией могут быть здоровыми (нередки случаи их кровного родства). У родственников больных М.-э. наблюдаются и другие заболевания ц. н. с. — эпилепсия, паркинсонизм, хорея, умственная отсталость, алкоголизм и др. Описаны изоляты с относительно высокой частотой М.-э. Наряду с семейными наблюдается немало спорадических случаев.
Классификация
Типизация миоклонической эпилепсии проводится по комплексному критерию: момент развития и основная клиническая картина. В системе. Соответственно, говорят о группе типов.
Доброкачественная миоклоническая эпилепсия младенческого возраста
Встречается в 30% всех случаев. Сопровождается малоспецифичными неврологическими симптомами, напоминающими гиперкинезы, тики. При мягком течении заподозрить неладное проблематично, потому как непроизвольные движения имитируют нормальную физическую активность ребенка. Нарушение охватывает плечевой пояс, лицо, руки. Интеллектуальное развитие не страдает. На долю торможения психического развития приходится до 5% всех описанных случаев. Манифестация миоклонической эпилепсии младенчества отмечается в период с 2 месяцев до 3 лет жизни.
Синдром Драве
Встречается в первый год жизни. Напоминает классическую описанную выше младенческую форму. У детей приводит к выраженному психическому дефициту, который проявляется олигофренией, глубокой умственной отсталостью. Неврологические явления также выраженные. Приступы без лечения возникают с частотой до нескольких раз в неделю. Не всегда для этого требуется интенсивная стимуляция головного мозга.
Синдром Унферрихта-Лундборга
Имеет генетическую, наследственную обусловленность. Сопровождается тяжелым неврологическим дефицитом, дает психические нарушения. Манифестация приходится на юношеские годы, ближе к концу полового созревания. Реже в возрасте до 10 лет. Частота подобных случаев определяется в 10-15%.
Миоклоническая эпилепсия юношеского возраста
У детей до 16 лет встречается исключительно редко, хотя возможно и такое. Характерная черта — полное отсутствие неврологических расстройств, стойкого дефицита, психических нарушений. Основной симптом — тонико-клонические пароксизмы. То есть классические судорожные приступы. Интересно, что развиваются они на фоне полностью сохранного, ясного сознания (не считая редких исключений).
Иногда выделяют так называемые абсансы. Они не считаются отдельной формой заболевания. Это очередной симптом в рамках клинической картины миоклонической эпилепсии. Не вдаваясь в подробности, это пароксизмы, напоминающие типичные судорожные приступы.
Классификация используется врачами для уточнения клинической картины, выработки тактики диагностики, дальнейшей терапии.
Существует динамическая классификация, основанная на оценке расстройства в развитии. Соответственно, выделяют:
- Прогрессирующий тип. Эта форма сопровождается постепенным неуклонным нарастанием неврологического дефицита, психических расстройств. По мере дальнейшего движения патологического процесса возникает риск летальных осложнений. Лечение помогает не во всех случаях. Прогрессирующая миоклоническая эпилепсия плохо поддается терапии.
- Стабильная форма. Клиника всегда примерно на одном уровне.
- Ремитирующая или регрессирующая разновидность. Симптомы развиваются на непродолжительный период времени. Затем затухают. Если смотреть в глобальном аспекте, наблюдается постепенное отступление заболевания, восстановление нормального самочувствия.
Патологическая анатомия
При патологоанатомическом исследовании в головном мозге обнаруживаются дистрофические изменения, наиболее выраженные в зубчатом ядре мозжечка, оливах продолговатого мозга, черном веществе, полосатом теле, таламусе (зрительном бугре), в разных участках коры мозга. Характерным, но не обязательным гистопатологическим признаком М.-э. является наличие одного-двух шарообразных амилоидных включений преимущественно в нервных клетках, к-рые были открыты Лафорой (G. R. Lafora, 1911) и названы его именем. Тельца Лафоры обнаруживаются не только в ганглиозных клетках головного и спинного мозга, но также и в корешках спинномозговых нервов, в периферических нервах, скелетных мышцах, печени, селезенке. Во многих нервных клетках имеются также значительные скопления липофусцина.
Клиническая картина
В большинстве случаев болезнь начинается в возрасте 10—15 лет. Для нее характерно сочетание миоклонического гиперкинеза с эпилептическими припадками. У одних больных первыми симптомами являются миоклонии (см.), а общие эпилептические припадки (см. Эпилепсия), обычно ночные, присоединяются позже, нередко спустя ряд лет. У других больных вначале наблюдаются только эпилептические припадки, без миоклонического гиперкинеза, к-рый появляется позже. Кроме больших эпилептических припадков с потерей сознания, клонико-тоническими судорогами, недержанием мочи, прикусом языка, могут возникать и другие проявления эпилепсии — малые припадки, абсансы (разновидность малого эпилептического припадка), сумеречные состояния и др.
При М.-э. миоклонический гиперкинез характеризуется большим разнообразием и имеет свои особенности. Первоначально возникающие клонические подергивания являются чаще изолированными, могут наблюдаться в одной мышце; преимущественно сокращается четырехглавая мышца бедра, с незначительным двигательным эффектом. В дальнейшем миоклонии становятся все более распространенными, захватывают мышцы конечностей, туловища, головы, увеличивается их частота и двигательный эффект.
В большинстве случаев наблюдаются миоклонии быстрого темпа, молниеносные, беспорядочные, неритмичные, асинхронные, нерегулярные. Они значительно уменьшаются и прекращаются в спокойном состоянии, в лежачем положении, отсутствуют во время сна. Их усиливают произвольные движения и эмоции, особенно отрицательные. Наблюдаются так наз. сенсоклонические реакции — неожиданно возникший яркий свет, громкий звук вызывают кратковременный миоклонический приступ в виде внезапного усиления мышечных сокращений в конечностях, туловище, лице с резкими общими вздрагиваниями.
Миоклонический гиперкинез проявляется в различной степени в разные дни — он может значительно затихать или, наоборот, усиливаться, в связи с чем сами больные отмечают у себя чередование «хороших» и «плохих» дней. Иногда у нек-рых больных появляются психотонические приступы, описанные Лундборгом. Они выражаются в том, что под влиянием эмоциональных воздействий у больного возникает кратковременное тоническое напряжение всей мускулатуры без утраты сознания.
Описаны редко встречающиеся сочетания миоклонического гиперкинеза с хореоатетозом (см. Гиперкинезы). Имеется тесная связь между миоклоническими гиперкинезами и эпилептическими припадками. Изо дня в день усиливающиеся миоклонии постепенно становятся особенно резко выраженными, на высоте которых больной на короткое время теряет сознание, появляются клонико-тонические судороги с прикусом языка и недержанием мочи. После окончания эпилептического припадка сразу исчезают миоклонии, обычно на один-два дня, а затем они появляются вновь и постепенно усиливаются. Миоклонус-эпилепсия имеет прогрессирующее течение. Из-за миоклоний у больных затруднена и постепенно становится невозможной ходьба и выполнение других произвольных движений, они не могут себя обслуживать, самостоятельно принимать пищу. У отдельных больных наблюдаются легкие мозжечковые расстройства (атаксия, интенционное дрожание), мышечная гипотония. Чувствительность сохранена. Парезов, рефлекторных нарушений не отмечается. В поздних стадиях болезни развивается Экстрапирамидная обездвиженность с клин, картиной паркинсонизма (см.), при этом исчезает миоклонический гиперкинез.
За небольшими исключениями, больные деградируют психически.
На ранних этапах заболевания отмечаются астеноневротические расстройства, в дальнейшем больные становятся все более вялыми, апатичными, снижается интерес к окружающему, ухудшается память, ослабевает сообразительность, критика, временами вялость сменяется раздражительностью, бывают состояния спутанности с галлюцинаторными переживаниями, у многих развивается тяжелая деменция (см. Слабоумие). При электроэнцефалографическом исследовании (см. Электроэнцефалография) часто обнаруживаются пароксизмы электрической активности высокой амплитуды. Световая стимуляция, гипервентиляция усиливают пароксизмальную электрическую активность мозга. В сыворотке крови больных часто обнаруживается уменьшение содержания мукополисахаридов. По данным нек-рых авторов, для М.-э. характерна также повышенная концентрация в крови аргининсукцининовой к-ты.
Юношеская миоклоническая эпилепсия (ЮМЭ) как отдельная форма идиопатической генерализованной эпилепсии с возрастозависимым началом была выделена в 1969 г. D. Janz [1], хотя имеются данные и в более ранней работе этого автора, совместной с W. Christian, в которой она была названа «импульсивной petit mal» [2]. Кроме того, имеется первое описание больного, которое датируется 1867 г. [3]. Тем не менее, несмотря на длительный период изучения ЮМЭ, в настоящее время остаются вопросы и нерешенные проблемы в отношении ее диагностики и лечения.
В статье проведен сравнительный анализ результатов наших исследований в соответствии с работами других авторов. Сравнивались результаты исследования В.А. Карлова и Н.В. Фрейдковой [4] 72 больных ЮМЭ, а также новой выборки больных за последние 5 лет (20 человек) с материалами исследований отечественных и зарубежных авторов, относящихся к тому же временному периоду. Рассмотрена эволюция проблемы в аспектах клинической диагностики, терапии, прогноза заболевания и социальной адаптации больных ЮМЭ.
Возраст дебюта данной формы эпилепсии в литературе указан с большим разбросом, что связано с нефиксированной точкой начала заболевания. Это объясняется тем, что дебютом заболевания, как правило, являются миоклонии, которым больные, а зачастую и врачи не придают должного значения. Если в предыдущих наших исследованиях ранний дебют отмечен в 10 лет, а поздний в 26, то сейчас зафиксирован случай более раннего дебюта, а именно — в 9-летнем возрасте.
Что касается генетического аспекта ЮМЭ, то еще в работах F. Elmslic и соавт. [5] и позднее другими авторами [6—8] были идентифицированы патологические гены — BRD2
и
EFHCI
с локусом на хромосомах 6p21, 6p12—p11 (
EJM1
) и 5q14 (
EJM2
) с дефектом одного из генов — миоклонином. Кроме того, подтверждено наличие распространенных нарушений на микроструктурном уровне в белом веществе головного мозга — в лобной доле и мозолистом теле. Наличие этих изменений связывается с лобной когнитивной дисфункцией, на что обратил внимание еще D. Janz [1], который первым описал эту форму заболевания. Он же подчеркивал, что, хотя большинство случаев ЮМЭ и являются изолированными (единичными), примерно у 1/3 пациентов имеется заболевание эпилепсией в семье. Данные P. Thomas и соавт. [9] указывают, что в семьях больных ЮМЭ наблюдается сегрегация больных с идиопатической генерализованной эпилепсией, и примерно около 5% родственников I степени больны эпилепсией.
По данным наших последних наблюдений, эпилепсия в семье отмечалась у 1 родственника I степени и у 5 родственников I степени по данным опубликованных ранее исследований. В 2014 г. было проведено исследование [10] клинико-генеалогических данных у пробандов с ЮМЭ и членов их семей. Изучены 13 неродственных семей, в которых как минимум 2 члена страдали эпилептическими приступами. Не был обнаружен ни материнский, ни какой-либо другой тип наследования. Найден гетерогенный фенотип у лиц II и III степени родства: в семьях с ЮМЭ обнаруживаются другие формы эпилепсии, в частности с генерализованными тонико-клоническими приступами (ГТКП) у лиц с поздним началом ЮМЭ.
Приводим соответствующее собственное наблюдение.
Больная 18 лет обратилась с жалобами на приступы с 11-летнего возраста — «такие же, как у матери», при пробуждении, и единичный генерализованный судорожный приступ (ГСП) в 13-летнем возрасте. Последние два года принимает конвулекс по 750 мг 2 раза в сутки, приступов не было. Срыв клинической ремиссии наступил с возникновения приступа «вокруг сна» (при засыпании).
Рождена от 23-летней матери, роды в срок, стимулированные. Мать больной ранее лечилась с диагнозом ЮМЭ: роняла предметы из рук, были утренние подергивания в руках. По назначению невролога принимала в течение года люминал, а затем три года фенитоин (дифенин), что, естественно, усилило приступы. В 20-летнем возрасте самостоятельно прекратила принимать назначенные противоэпилептические препараты (ПЭП), в это же время приступы практически прекратились: остались только подергивания, провоцируемые психоэмоциональным стрессом.
При обследовании самой больной в неврологическом статусе выявлена легкая асинергия Бабинского. МРТ головного мозга показала обширную субарахноидальную кисту в левой лобно-теменной области, несомненно врожденную. На предыдущей ЭЭГ имели место мягкая дезорганизация фона, отсутствие фотосенсетивности и эпилептиформного ответа на гипервентиляцию. В то же время в фазе медленноволнового сна были зарегистрированы эпилептиформные разряды по типу острой-медленной волны и спайк-волны, в основном возникающие в лобных отведениях, локальные или иногда генерализующиеся. Последняя ЭЭГ показывает значительную их редукцию.
В приведенном наблюдении имеется ряд особенностей. Во-первых, у матери больной с клинической картиной ЮМЭ в 20-летнем возрасте на фоне самоотмены ПЭП (которые, кстати, ей были противопоказаны) сохранилась только редкая психоэмоциональная провокация миоклоний. Во-вторых, у дочери сочетание утренних миоклоний с единичными генерализованными судорожными приступами (ГСП), связанными со сном, дает известное основание для диагноза ЮМЭ. В то же время можно, как мы полагаем, квалифицировать данный случай как «стертую» форму ЮМЭ, поскольку отсутствовали характерные вздрагивания и падения предметов из рук. Можно полагать, что у матери имелась «стертая» форма ЮМЭ. В принципе, эти наблюдения подтверждают существование проблемы миоклоний, связанных со сном, возможно, за пределами эпилепсии.
Как известно, ЮМЭ имеет характерный клинический паттерн: билатеральные, чаще асимметричные нерегулярные аритмичные толчкообразные миоклонические подергивания мышц плечевого пояса и самих рук различной амплитуды. При этом миоклонические подергивания в значительной степени игнорируются больными, в связи с чем пациенты, как правило, не обращаются с этими жалобами к врачам. Однако вряд ли их можно назвать неосознаваемыми, поскольку на наводящие вопросы врача следует описание больным этих приступов. Скорее, данный феномен можно объяснить характерными особенностями психики больных (анозогнозия) [1].
Другим характерным клиническим проявлением этой формы эпилепсии является генерализованный миоклонический феномен — вздрагивание. В отличие от физиологических вздрагиваний данное проявление заболевания при ЮМЭ возникает не столько во сне, сколько в период пробуждения. У одной из наблюдаемых нами пациенток вздрагивания преобладали при отходе ко сну. Это сближает ЮМЭ с эпилепсией с ГТКП пробуждения, при которой припадки могут проявляться «вокруг сна».
Подтверждается сочетание миоклоний в большинстве случаев с редкими ГТКП (60%). По нашим последним наблюдениям, среднее время возникновения ГТКП после появления миоклоний составило около 4 лет. Сочетание миоклонии только с абсансами остается довольно редким явлением: ранее мы наблюдали всего один случай, за последние 5 лет подобных случаев в наших наблюдениях не было.
Сочетание миоклоний, ГТКП, атипичного абсанса и ауры, что вызывает некоторые диагностические трудности, нашло отражение в следующем клиническом наблюдении.
Больная Х.
, 29 лет, обратилась в июле 2013 г. Она по профессии психолог, но не работает.
Пренатальный и постнатальный анамнез без особенностей, наследственность не отягощена, со слов матери, «выдавливали» во время родов. На фоне видимого здоровья, но при этом хронического недосыпания, в апреле 2012 г. во время поездки на работу в поезде случился первый и единственный ГТКП с предшествующим ощущением нереальности происходящего (более точно его описать пациентка не смогла). Ко времени обращения к нам уже была назначена терапия — топамакс 50 мг в сутки, ламиктал 100 мг 2 раза в сутки. Это вызвало ухудшение — появление вздрагиваний, чаще связанных со сном.
При МРТ на одном из аксиальных базальных срезов в режиме Т2 обнаружено усиление сигнала от полюса левой височной доли. ЭЭГ сна представлена эпизодами генерализованных спайков и полиспайк-волн единичных и/или продленных до нескольких секунд (в этих случаях напоминающих атипичный абсанс).
Учитывая, что в анамнезе у больной была операция по поводу двустороннего поликистоза яичников (менструальный цикл не нарушен), а средством первой линии выбора при доминирующем клиническом проявлении миоклоний может быть леветирацетам, было принято решение отменить ламиктал и добавить кеппру 500 мг 2 раза в сутки. В сентябре 2013 г. был второй ГТКП, который пациентка амнезировала, но при этом, видимо, чувствовала его начало (ушла из кухни и легла в постель). Кроме того, бывает изолированное трудноидентифицируемое состояние дереализации. Подергивания при этом уменьшились. Доза кеппры была увеличина до 750 мг 2 раза в сутки и присоединен топамакс по 50 мг 2 раза в сутки (с учетом избыточной массы тела пациентки). Последовало учащение приступов до одного в неделю в состоянии бодрствования, пациентка самостоятельно отменила ПЭП. После чего ГТКП не было, однако в ночное время во сне случались общие вздрагивания. При проведении 12-часового ЭЭГ-мониторинга зарегистрированы в периоды бодрствования и сна билатерально-синхронные пик-волновые и полипик-волновые разряды частотой 3,5—4, длительностью 3—5 с.
Этот случай вначале представлял диагностические трудности: дифференциальный диагноз проводился между ЮМЭ и фенокопией ЮМЭ. Не характерным, хотя и возможным для ЮМЭ было начало заболевания с ГСП, учащение судорожных приступов в ходе заболевания и картина ЭЭГ, в значительной степени представленная коррелятом атипичного абсанса. Другой особенностью, которая и послужила вначале поводом для обсуждения диагноза ЮМЭ, было появление миоклоний, как правило, связанных со сном, в связи с их появлением после назначения комбинации топамакса (прописанного в связи с избыточной массой пациентки) с ламотриджином. Поскольку оба этих препарата, хотя и редко, могут провоцировать появление миоклоний, сам по себе факт возникновения миоклоний не после пробуждения, а во время сна не отрицал диагноза ЮМЭ. Наконец, существенно еще одно обстоятельство: самоотмена препаратов совпала со спонтанной ремиссией ГСП, хотя вздрагивания сохранялись. Таким образом, данный случай демонстрирует, что миоклонии являются сущностью заболевания. Что касается ГСП, очевидно, что первый из них был спровоцирован недосыпанием, а последующее появление и учащение приступов приходится расценивать как результат неэффективного или даже парадоксального эффекта ПЭП.
Вернемся к диагнозу. Дебют заболевания с 10-летнего возраста, когда отмечались кратковременные эпизоды «замирания» и вздрагиваний; первый приступ, возникший в поезде, видимо, связанный с дефицитом сна, и генерализованные изменения, выявленные при ЭЭГ, могли бы свидетельствовать об идиопатической природе заболевания: ЮМЭ относится к идиопатической эпилепсии с варьирующим фенотипом. В то же время у пациентки с ГСП имеет место трудноидентифицируемая аура, которая также бывает в виде изолированного проявления; трансформация судорожных приступов из асинхронных в приступы бодрствования — признаки, характерные для симптоматической и в значительной степени — криптогенной эпилепсии. Уже в классификации 1989 г. была выделена форма эпилепсии с синдромами, имеющими признаки как фокальных, так и генерализованных. В предложенной позже и до сих пор не принятой классификации в разделе «Эпилептические синдромы и родственные состояния» вышеуказанная рубрика удалена [11, 12]. Однако новый состав Комиссии Международной противоэпилептической лиги (МПЭЛ) по классификации и терминологии эпилепсии, возглавляемый I. Scheffer [13], недавно предложил ввести раздел «Неклассифицированные эпилепсии», в который относятся случаи, не распознающиеся как известные электроклинические синдромы, или неизвестной этиологии. Таким образом, данный случай не относится к конкретным электроклиническим синдромам и может быть причислен к неклассифицируемым формам эпилепсии.
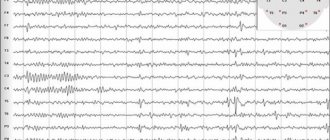
Так как ЮМЭ может изначально длительно проявляться только миоклониями, особая ценность принадлежит ЭЭГ. ЭЭГ при ЮМЭ характеризуется такими особенностями, как наличие коротких вспышек полиспайк- и спайк-волн 3—6 в с (рис. 1); разряды генерализованных симметричных спайк-волн 3 в с и редко 1—2 в с; эпилептические разряды, отличающиеся высокой, иногда гигантской амплитудой. Чаще выявляется лобно-долевая активность (рис. 2 и 3), сон резко активизирует эпилептиформную активность, при этом акцент также может обнаруживаться и в некоторых других отведениях. Хотя клинически абсансы наблюдались в единичных случаях, во время записи ЭЭГ коррелят абсанса зарегистрирован в 18,1% в ранних исследованиях и в 15% более поздних, в то время как ЭЭГ-коррелят миоклоний — у половины пациентов.
Рис. 1. ЭЭГ больной Х., 29 лет, с ЮМЭ.
Рис. 2. ЭЭГ больной Х., 29 лет. Лобно-долевая активность.
Рис. 3. Локализация эпилептического очага по данным отведений для ЭЭГ (объяснение в тексте).
У больных с ЮМЭ широко распространены фокальные ЭЭГ-проявления [14]. Так, в исследованиях E. Montalenti и соавт. [15], К.Ю. Мухина и соавт. [16] выявлены высокая частота региональных изменений и асимметрия диффузных пик-волновых разрядов. По мнению указанных авторов, эти «нетипичные» изменения на ЭЭГ нередко являются причиной ошибочного диагноза фокальной эпилепсии с феноменом вторичной билатеральной синхронизации. В связи с этим уместно упомянуть, что отечественные авторы подчеркивают: классическая клиническая картина является основополагающей в постановке диагноза, а ЭЭГ является всего лишь вспомогательным дополнительным методом исследования.
К сожалению, несмотря на характерную клиническую картину заболевания и прогресс в методиках исследования, в настоящее время все еще остается открытой проблема диагностики и назначения корректной терапии, хотя и наблюдаются положительные тенденции. Если ранее ставился правильный диагноз и адекватная терапия назначалась только 34,8% больных, то по данным последних исследований, стартовая терапия была корректно подобрана для 50%. Отметим, кстати, что все еще иногда назначается фенитоин.
Проблема диагностики подтверждается и некоторыми зарубежными работами. Так, ретроспективное наблюдение 200 пациентов с ЮМЭ, проходивших амбулаторно-поликлиническое обследование за 2014—2015 гг. [17], обнаружило некорректно поставленный диагноз в 49 случаях с дебютом заболевания с ГТКП и регистрацией на ЭЭГ в 56% случаев генерализованных спайк-волновых или полиспайк-волновых разрядов. В случаях начала заболевания с миоклонических приступов диагноз не вызывал трудностей. Почти половине пациентов были назначены неадекватные ПЭП, остальным рекомендовано наблюдение. По сравнению с данными исследований 1998 г. частота ошибочного диагноза стала меньшей, а время постановки корректного диагноза короче. Тем не менее диагностика «с первого взгляда» все еще остается проблемой среди неврологов, даже если имеют место типичные изменения в ЭЭГ.
Обоснованный диагноз ЮМЭ, однако, еще не гарантирует оптимального ответа на терапию. Этот факт нашел свое отражение в работе [18] по исследованию 116 пациентов с ЮМЭ, наблюдаемых по меньшей мере 18 мес каждый. У 68 пациентов за последние 12 мес приступов не было, а у 48 был зарегистрирован хотя бы один приступ разного типа. Наиболее частыми негативными факторами, обнаруженными в последней группе, были: короткий период наблюдения, лекарственное средство, отличное от вальпроевой кислоты (ВК), плохая приверженность к терапии. В частности, в связи с этим авторы рекомендуют шире использовать вальпроаты. Другими исследователями [19] отмечено, что у 19% из 201 пациента с ЮМЭ с отсутствием реакции на ВК обнаружены существенные корреляции и ассоциации с психическими расстройствами. Это, а также другие проблемы терапии и причины возникновения рецидива рассматриваются в этой статье.
Одной из проблем в терапии ЮМЭ, как и при других формах эпилепсии, являются побочные реакции.
Больная З.
, заболела в 11—12 лет, когда появились подергивания по утрам после сна, роняла из рук предметы. Были проведены МРТ- и ЭЭГ-исследования, после чего нарушения были расценены как функциональные тики. В 15-летнем возрасте перенесла сальмонеллез, на фоне которого развилась резкая головная боль, сопровождающаяся рвотой, усиливающаяся при вертикализации. Прошла курс лечения в инфекционном отделении, однако головная боль не была купирована, заподозрен объемный процесс в головном мозге. В мае того же года обследована в Научном центре неврологии, был поставлен диагноз «миоклонии» и назначены клоназепам и финлепсин. Отмечался положительный эффект стартовой терапии, но на контрольных ЭЭГ сохранялась эпилептиформная активность. Спустя год на фоне вынужденной самоотмены препаратов (закончились ПЭП на отдыхе) утром развился ГТКП. Была увеличена дозировка клоназепама. Четырьмя годами позже во время утреннего туалета в ванной комнате был эпизод кратковременной потери сознания, послеприступного сна не было.
В это время больная впервые обратилась к авторам статьи, и было изменено лечение: назначен депакин энтерик по 300 мг 3 раза в день. Состояние пациентки значительно улучшилось: подергиваний не наблюдалось, а все последующие ЭЭГ были с положительной динамикой. Однако появились побочные реакции: увеличение массы тела, нарушение менструального цикла, гирсутизм. Было решено назначить кеппру по 750 мг 2 раза в день и уменьшить дозировку депакина. Так как побочные эффекты депакина сохранялись, пришлось в течение года полностью снять депакин, но через 3 мес продолжалось ухудшение ЭЭГ. При увеличении дозировки кеппры до 2000 мг в день состояние оставалось прежним. Во время одного из приступов пациентка чуть не упала на лестнице, вновь в терапию ввели депакин 300 мг/сут. Спустя год на ЭЭГ зарегистрировано выраженное ухудшение, по согласованию с больной было решено перейти на комбинированную терапию топамаксом по 100 мг 2 раза в день и депакином энтерик по 300 мг 2 раза в день. На ЭЭГ стала отмечаться положительная динамика. Позже была проведена попытка снять депакин, однако усилилась слабость в руках, появилась неуверенность по утрам, закатывание глаз, на ЭЭГ регистрировалась отрицательная динамика. Было решено вернуться к дозировке депакина по 300 мг 2 раза в день.
Данный случай мы приводим не для иллюстрации побочных эффектов ВК, они общеизвестны, а для того чтобы показать, какие трудности могут возникнуть при ее непереносимости. Возможно, надо было попытаться применить другие формы ВК.
Известно, что чаще ЮМЭ встречается у лиц женского пола в соотношении 2:1. Это отражает другую сторону проблемы — гендерный аспект. Несмотря на то что вальпроаты по эффективности действия являются препаратами первой линии при ЮМЭ, они во многих случаях не могут быть использованы в эффективной дозе у лиц женского пола репродуктивного возраста из-за выраженных побочных явлений, как это было проиллюстрировано выше. Эта проблема обсуждалась Европейской академией неврологов, и была принята рекомендация ограничения применения вальпроатов у этой категории больных [20].
V. Puri и соавт. [21] попытались найти нейрофизиологический механизм преобладания заболеваемости у женщин с использованием метода транскортикальной магнитной стимуляции у ранее не лечившихся больных. Найдена повышенная активность в корковой ингибиторной нервной сети, «очевидно вследствие длительного кортикального периода молчания». Это явление было обнаружено только у пациентов женского пола, чем авторы объясняют повышенную чувствительность к данному заболеванию в когорте у женщин и соответственно возможное значение гормонального фактора (эстроген).
В связи со сказанным является актуальным дальнейший поиск альтернативного препарата ВК для терапии ЮМЭ у женщин.
Заменой вальпроатов при лечении ЮМЭ может являться леветирацетам, высокоэффективный в отношении как миоклоний [22, 23], так и в блокировании интериктальных эпилептиформных разрядов и фотопароксизмального ответа на ЭЭГ [24].
В 2007 г. было проведено исследование [25] 30 пациентов, лечившихся леветирацетамом, из которых 80% достигли полной ремиссии при монотерапии леветирацетамом. При этом финальные терапевтические дозировки колебались от 12 до 50 мг/кг в сутки. Данное исследование подтвердило вероятность рассмотрения леветирацетама в качестве препарата первой линии при ЮМЭ.
Одним из авторов данной статьи совместно с Н.В. Фрейдковой [26] было проведено исследование, в котором оценивалась эффективность применения невысоких доз вальпроатов и леветирацетама в лечении идиопатических форм эпилепсии, у 13 из 23 пациентов была ЮМЭ. При этом группа пациентов с ЮМЭ (как в сочетании с ГТКП, так и без них) была наиболее репрезентативна в достижении наилучшего терапевтического эффекта. Так, комплексная терапия упомянутыми ПЭП привела к медикаментозной ремиссии у 6 из 8 больных; в 1 наблюдении частота приступов снизилась более чем на 75%, и еще в 1 — более чем на 50%.
В другом исследовании [27] эффективности леветирацетама в монотерапии у 4 пациентов с ЮМЭ (2 пациенткам из которых препарат был назначен впервые в связи с планированием беременности, остальные были переведены на терапию карбамазепином в связи с уточнением диагноза) применение ПЭП позволило достичь ремиссии приступов в течение 6 мес.
В то же время, по некоторым данным литературы [28], леветирацетам не уступает по эффективности вальпроатам. Отечественными авторами проведено обширное ретроспективное исследование базы данных 1159 пациентов Волгоградской области, из которых 78 страдали ЮМЭ. Срок наблюдения составил от 1 года до 6 лет. В 56% случаев пациенты с диагнозом ЮМЭ находились на монотерапии вальпроатами, в 17% случаев применялся леветирацетам. Частота достижения медикаментозной ремиссии составила 83%, при этом при применении монотерапии вальпроатами — 92%, леветирацетамом — 87%. Полная клинико-ЭЭГ-ремиссия достигнута в 41% случаев, преимущественно при применении вальпроатов.
Также наряду с изучением вальпроата проведено проспективное рандомизированное исследование [29] по применению ламотриджина у пациентов с дебютом ЮМЭ во взрослом возрасте, в котором сравнивали его эффективность и переносимость относительно В.К. Получены данные, свидетельствующие об эффективности и лучшей переносимости ламотриджина именно у взрослых пациентов с ЮМЭ, хотя распространенность идиосинкразических реакций может быть причиной беспокойства.
Следует отметить, что в современной научной литературе не поднимается вопрос о состоянии детей, рожденных от больных ЮМЭ матерей, а также роли мужской наследственности. Приведем несколько примеров из нашей практики, в частности в таких случаях, как описываемый далее.
Больная Л.
, 37 лет, впервые обратилась в 18-летнем возрасте после ГСП, в связи с тем, что у нее прекратился менструальный цикл (приступ был накануне начала менструации). Второй ГСП сна случился через неделю уже на фоне менструации. В дальнейшем был лишь единичный ГСП. Что касается миоклоний, то они периодически повторялись. Пациентка жаловалась на частые тревожные сны, в связи с чем был назначен феназепам. В первый раз при обследовании больной на ЭЭГ обнаружены комплексы острая—медленная волна лобно-височной локализации по альтернирующему типу, последней ЭЭГ в состоянии бодрствования был отмечен эпизод генерализованных высокоамплитудных спайк-волн с максимальной выраженностью в передних отделах головного мозга. За все это время пациентка была три раза беременна, две беременности прерваны по социальным показаниям, одна состоялась. На январь 2015 г. ребенку 15 лет. Он отличался девиантностью поведения, снижением уровня интеллекта; до 13 лет у него был ночной и дневной энурез, учится в коррекционной школе.
С момента возникновения заболевания пациентка постоянно принимает депакин хроно по 300 мг 2 раза в сутки и ламотриджин (ламолеп) по 100 мг 2 раза в сутки. Судорожных приступов нет, сохранились вздрагивания по утрам.
Следует отметить, что результаты исследования K. Meador и соавт. [30] продемонстрировали снижение IQ (коэффициент интеллекта) у детей школьного возраста, матери которых применяли ВК во время беременности, на 7—10 пунктов по сравнению с другими ПЭП.
На сегодняшний день проведен ряд исследований отдаленных исходов использования ВК во время беременности, результаты которых свидетельствуют о 3-кратном увеличении частоты расстройств аутистического круга и 4-кратном — аутизма у детей наряду с популяционными показателями. Часть работ дает основание полагать, что у таких детей развивается синдром дефицита внимания и гиперактивности [31—33].
Влияние ВК на умственное и физическое развитие детей при ее применении в период беременности зависит от дозировки, хотя порог доз не определен. Данная проблема и ряд вопросов беременности при ЮМЭ на фоне монотерапии ВК подробно рассмотрены в статье П.Н. Власова [34].
Наличие перечисленных проблем подтверждается существованием таких случаев, как приводимый ниже.
Судорожные приступы возникли у 6-летнего ребенка, рожденного от отца с ЮМЭ. Дебют заболевания у отца начался со сложного парциального приступа во сне (автоматизм). Ему была назначена стартовая терапия карбамазепином (финлепсин) по 200 мг 2 раза в сутки. На этом фоне у пациента наряду с повторяющимися сложными парциальными приступами появились приступы «вздрагивания». На ЭЭГ была обнаружена региональная и генерализованная спайк- и полиспайк-волновая активность. Затем постепенно карбамазепин был заменен на депакин по 500 мг 2 раза в сутки. Эпилептическая активность на ЭЭГ регрессировала, подергивания прекратились. Спустя два года с учетом клинико-ЭЭГ-ремиссии была проведена попытка снижения дозы депакина до 600 мг в сутки при концентрации препарата в крови 48,3—50,8 мкг/мл, однако на ЭЭГ появилась абсансная активность в периоде ночного сна. При повышении дозы до 300 мг утром и 500 мг вечером произошло возобновление вздрагиваний в руках. Полная ремиссия была достигнута при дозе препарата 1000 мг в сутки (по 500 мг на 2-кратный прием). Что касается ребенка, то перинатальный анамнез, со слов родителей, не отягощен, но он наблюдается у невролога с диагнозом «детский церебральный паралич, симптоматическая эпилепсия с редкими судорожными приступами на фоне противоэпилептической терапии».
К сожалению, генетический анализ в описанном случае не проводился, поэтому возможный вклад генетического фактора остается недоказанным. Другим немаловажным, но нерешенным как для самого пациента, так и для членов его семьи остается вопрос дальнейшего прогноза болезни.
В работе J. Gaithner и соавт. [35] на основании анализа больных, наблюдавшихся не менее 25 лет, выделены факторы неблагоприятного прогноза: начало с ГСП, предшествующих миоклониям, безуспешность терапии и политерапии. В разрез общепринятому мнению, длительное лечение не обязательно, кроме тех пациентов, у которых имеются указанные факторы неблагоприятного прогноза. В то же время в наших исследованиях у 30 больных отмена ПЭП после 5-летней медикаментозной ремиссии оказалась возможной лишь у 9, в остальных случаях наступал рецидив. Не исключено, что данное явление в какой-то степени связано с поздним началом адекватно подобранной терапии. По нашим наблюдениям, за последние 5 лет отмечено 3 случая из 20 с полной клинико-медикаментозной и ЭЭГ-ремиссией на фоне лечения ВК и/или леветирацетамом.
В исследовании К.Ю. Мухина и соавт. [16] у 106 пациентов с ЮМЭ клиническая ремиссия была достигнута в большинстве случаев (89,6%), а клинико-ЭЭГ — в 22%. У большинства пациентов (79%) применяли монотерапию, наиболее часто использовали ВК (56%), реже — леветирацетам (13%). К сожалению, несмотря на высокую эффективность лечения, авторы отмечают высокий процент (92%) возникновения рецидивов, наиболее часто — на этапе снижения дозы более чем на 50% и в течение первого года после отмены. Авторы связывают это с такими достоверными факторами, как недосыпание (23,5%), самостоятельная отмена, снижение дозы или пропуск приема ПЭП, замена на дженерики (21%).
О затруднениях в социальной адаптации, необычном стиле жизни и плохом сотрудничестве с врачом у пациентов с ЮМЭ впервые упомянули D. Janz и W. Cristian [2]. Подобные изменения, достигающие степени психических нарушений, зарегистрированы в 25,6% [36, 37].
Поскольку своеобразные психические нарушения у больных с ЮМЭ связываются с когнитивными нарушениями за счет лобных долей [20, 38], бразильские авторы предприняли специальное исследование в этом направлении на контингенте из 42 пациентов с несомненным диагнозом ЮМЭ и 42 лиц контрольной группы с применением батареи тестов. Полученные данные показали, что пациенты с ЮМЭ имеют худшую адаптацию в 2 значимых аспектах жизни — работе и семейных отношениях, однако этот фактор коррелирован не с когнитивными нарушениями, а с высокой частотой приступов и импульсивностью [39].
Значимым фактором для больного и его родственников является ранний прогноз заболевания. Авторы одной из работ [40] изучали чувствительность к закрыванию глаз при ЮМЭ и эффективность прогноза у 76 пациентов с минимальным сроком наблюдения в течение года. У 15,8% был плохой прогноз в связи с резистентностью к адекватным ПЭП, 19,7% были псевдорезистентны (т.е. их неправильно лечили) и 64,5% имели хороший прогноз. Они также изучали чувствительность к закрыванию глаз. Она была обнаружена только у 4 (5,3%) больных и только тех, у которых был плохой прогноз. Таким образом, фотосенситивность, вероятно, относится к факторам, ухудшающим прогноз.
В литературе имеются данные [41], касающиеся связи фотопароксизмального ответа на ЭЭГ и данных оптической когерентной томографии. У группы пациентов с наличием фотопароксизмального ответа на ЭЭГ было обнаружено увеличение толщины retina nerve fiber layer
обоих глаз и сосудистой оболочки правого глаза. Толщина сетчатки обоих глаз была существенно меньше. Авторы считают, что данные микроструктурные особенности могут быть связаны с фотосенситивностью у пациентов с ЮМЭ. В других исследованиях [40] было показано, что eye closure sensitivity (ECS) у пациентов с ЮМЭ является редкой ЭЭГ-находкой и не может быть достоверным маркером плохого прогноза.
Известно, что одну из главных ролей в патогенезе ЮМЭ играет нарушение корковой пластичности. Группа итальянских ученых [42] изучали синаптическую пластичность моторной коры посредством метода парной ассоциативной стимуляции у пациентов с ЮМЭ и выявили соответствующие изменения.
Приведенные данные свидетельствуют о положительных сдвигах в диагностике и лечении ЮМЭ. Тем не менее, несмотря на характерную клиническую картину заболевания и прогресс современных методов исследования, а также большой клинический опыт, вопрос диагностики этой формы эпилепсии остается проблемой для неврологов. Определены факторы, отягощающие прогнозирование: сочетание миоклоний с ГТКП, наличие психических нарушений, фотосенситивность, отсутствие должного ответа на адекватные ПЭП. Открытым в настоящий момент все еще остается гендерный аспект заболевания, особенно в отношении терапии. Необходимо также накопление научной информации о детях, рожденных от матерей с ЮМЭ, и роли отцовской наследственности.
Авторы заявляют об отсутствии конфликта интересов.
Диагноз
Диагноз ставится на основании сочетания в клин, картине миоклонического гиперкинеза с эпилептическими припадками. Для диагностики важное значение имеет семейный характер заболевания. Дифференциальный диагноз проводится с весьма сходной мозжечковой миоклонической диссинергией Ханта — наследственным, аутосомно-рецессивным заболеванием, при к-ром также наблюдаются миоклонический гиперкинез и эпилептические припадки, но, в отличие от М.-э., мозжечковые расстройства гораздо более выражены. В отличие от М.-э., при кожевниковской эпилепсии (см.) клонические судороги наблюдаются в определенной части тела и обычно не носят генерализованного характера. Особенно трудно установить ранний диагноз в спорадических случаях, когда заболевание проявляется неполным клин, синдромом — или эпилептическими припадками, или миоклоническим гиперкинезом. В этом случае имеет значение семейный анамнез, а также уменьшение содержания мукополисахаридов в сыворотке крови.
Лечение
Терапия проводится консервативными методами. Лечение ювенальной миоклонической эпилепсии требует использования группы медикаментов.
Противоэпилептический препарат нового поколения Леветирацетам
Используются производные вальпроевой кислоты, специализированные противоэпилептические медикаменты нового поколения (Леветирацетам, как пример), барбитураты в малых дозировках, транквилизаторы на основе бензодиазепинов. Обычно проводится комбинированная терапия, средства первой линии лечения — вальпроаты. Карбамазепины используются у пациентов старшего возраста или при достижении больным возраста 16-18 лет, для терапии расстройства и его рецидивов во взрослые годы.
Лечение и Прогноз
Лечение симптоматическое. Применяется противосудорожная терапия, назначают фенобарбитал, бензонал, седуксен, хлоралгидрат. Последние два средства могут значительно уменьшить на короткое время миоклонический гиперкинез. Применение хлоралгидрата может вызвать привыкание к нему и быстрое развитие кахексии, Показаны также повторные длительные курсы лечения глутаминовой к-той.
Прогноз неблагоприятный. Средняя продолжительность болезни ок. 20 лет, нек-рые больные доживают до старческого возраста. Наиболее часто причиной смерти является нарастающая кахексия, нередко пневмонии и другие интеркуррентные заболевания.
Супругам, в семье к-рых есть больной Миоклонус-эпилепсией, для решения вопроса о рождении ребенка рекомендуется обратиться в медико-генетическую консультацию (см.).
Библиография:
Давиденков С. Н. Миоклонус-эпилепсия, в кн.: Неврол. и генетика, под ред. С. Н. Давиденкова, т. 2, с. 195, М., 1936; Дзержинский В. Myoclonia Unverricht’a, Журн, невропат, и психиат., кн. 5-6, с. 293, 1910; Маккьюсик В. А. Наследственные признаки человека, пер. с англ., М., 1976; Мельников С. А. Миоклонус-эпилепсия как синдром при некоторых заболеваниях головного мозга, Журн, невропат, и психиат., т. 57, в. 6, с. 740, 1957, библиогр.; de Ajuriaguerra J., Sigwald J. et Piot C. Myoclonie-epilepsie familiale de type Unverricht, Presse med., p. 1813, 1954; Bogaert L. Sur l’epilepsie-myoclonie progressive d’Unverricht — Lundborg, Mschr. Psychiat. Neurol., Bd 118, S. 170, 1949, Bibliogr.; Davison Ch. a. Keshner M. Myoclonus epilepsy, Arch. Neurol. Psychiat. (Chic.), v. 43, p. 524, 1940; Gambetti P. a. o. Myoclonic epilepsy with lafora bodies, Arch. Neurol. (Chic.), v. 25, p. 483, 1971; Hallidaу A. M. Les differents types des myoclonies, Rev. neurol., t. 119, p. 135, 1968; Handbook of clinical neurology, ed. by P. J. Yinken a. G. W. Bruyn, v. 15, p. 121, 1974, v. 27, p. 171, Amsterdam a. o., 1976; Lafora G. R. u. Glueck B. Beitrag zur Histopathologie der myoclonischen Epilepsie, Z. ges. Neurol. Psychiat., Bd 6, S. 1, 1911, Bibliogr.; LundborgH. Die progressive Myoclonus-Epilepsie, Up-sala, 1903; Unverricht H. Die Myoclonie, L]3z.— Wien, 1891.
P. А. Ткачев.
Как должен устанавливаться диагноз эпилепсии?
Согласно рекомендациям комиссии ILAE (2001), следует придерживаться пяти следующих пунктов:
- описание пароксизмального события (возможно по данным анамнеза);
- классификация приступов (анамнез, визуальное наблюдение, ЭЭГ);
- диагностика формы эпилепсии (клиника + ЭЭГ + нейровизуализация);
- установление этиологии (МРТ, кариотип);
- диагностика сопутствующих заболеваний и степени инвалидизации.
По этиологии выделяют три формы эпилепсии: идиопатические, симптоматические и предположительно симптоматические (криптогенные).
При идиопатических формах отсутствуют заболевания, которые могут быть причиной эпилепсии, она является самостоятельным заболеванием. В настоящее время установлена генетическая детерминированность идиопатических форм эпилепсии. Часто возникает вопрос о том, насколько велика вероятность наследования ребенком генерализованной идиопатической эпилепсии, если ею страдает один из родителей. На самом деле, вероятность этого невысока, она не превышает 8%.
Под симптоматическими формами подразумевают эпилептические синдромы с известной этиологией и верифицированными морфологическими нарушениями (опухоли, рубцы, глиоз, кисты, дисгенезии и др.).
К криптогенным (скрытым) относят формы, причина которых остается скрытой, неясной. Данные синдромы не удовлетворяют критерии идиопатических форм, но нет доказательств и их симптоматического характера, при визуализации структурные изменения не определяются.
Идиопатические генерализованные эпилепсии (ИГЭ) – наиболее часто встречающаяся группа эпилепсий в детской неврологии. Это своеобразные формы заболевания с генетической предрасположенностью. Генетический дефект многих форм найден: в основе патогенеза развития болезни лежат каналопатии (мембрана нейрона нестабильна и форма проявления будет генерализованной, поскольку страдают все клетки коры головного мозга).
Различают следующие формы ИГЭ:
- доброкачественные судороги новорожденных (семейные и несемейные);
- доброкачественная миоклоническая эпилепсия младенчества;
- детская абсанс эпилепсия;
- юношеская абсанс эпилепсия;
- юношеская миоклоническая эпилепсия;
- эпилепсия с генерализованными судорожными приступами пробуждения;
- первичная фотосенситивная эпилепсия.
ИГЭ включает различные эпилептические синдромы, при которых все приступы генерализованы с самого начала.
При ИГЭ не должны выявляться никакие другие причины возникновения заболевания, кроме генетических факторов, поскольку эта форма, по определению, идиопатическая.