Ауторегуляция мозгового кровотока (АМК) представляет собой защитный механизм, направленный на поддержание мозгового кровотока в ответ на изменения церебрального перфузионного давления (ЦПД) и цереброваскулярной резистентности (ЦВР) [1]. Термин был предложен N. Lassen в 1959 г. [2]. При этом ЦПД представляет собой разность между средним артериальным давлением и внутричерепным давлением (ВЧД) и обратно пропорционально ЦВР. ЦВР в свою очередь представляет суммарное сосудистое сопротивление, в том числе артериол мягкой мозговой оболочки и пенетрирующих прекапиллярных артериол мозга [3]. Скорость мозгового кровотока прямо пропорциональна ЦПД и обратно пропорциональна ЦВР.
Существует ряд механизмов, участвующих в регуляции поддержания уровня мозгового кровотока (норма — 50 мл/100 г/мин): 1) метаболические
(pH крови, баланс растворенных в крови CO2/O2, оксид азота, аденозин, продукты функционирования астроцитов и нейронов) [4, 5]; 2)
миогенные
(эффект Остроумова—Бейлиса — реакция со стороны гладкомышечного слоя артерий в виде сокращения при повышении АД и расслабления при его снижении); 3) периферические (или системные) (активность симпато-адреналовой системы, каротидных клубочков, температура, эндотелиальные факторы); 4)
нейрогенные
(сосудодвигательный центр, центры регуляции активности симпатической системы и, возможно, ряд других структур мозга). Звенья последних наименее изучены.
Все механизмы АМК обеспечивают поддержание церебральной перфузии при колебании АД в пределах 60—70 и 170—180 мм рт.ст. При повышении или снижении АД за пределы данного диапазона возникает срыв ауторегуляции — состояние, при котором мозговой кровоток пассивно зависит от системного АД, а ВЧД становится напрямую зависимым от артериального давления. Данное состояние опасно как развитием ишемии, так и развитием синдрома «роскошной перфузии» («luxury perfusion syndrome», реактивной гиперемии), ассоциированного с высоким риском вторичных ишемических или геморрагических осложнений.
АМК часто нарушается в остром периоде тяжелой черепно-мозговой травмы (тЧМТ), протекающей с нестабильностью гемодинамики и ассоциирована с неблагоприятным исходом. Оценка состояния АМК в настоящее время служит основным объективным ориентиром для мониторинга и коррекции консервативного лечения и принятия решения о нейрохирургическом вмешательстве в остром периоде тЧМТ [6]. Для пациентов с нарушенной ауторегуляцией вследствие тЧМТ достижение рекомендуемого уровня ЦПД (не ниже 70 мм рт.ст.) может быть связано с мозговой гиперемией, предрасполагающей к формированию внутричерепной гипертензии, отеку и внутримозговым кровоизлияниям [6]. Поэтому, согласно последним рекомендациям, для данной группы пациентов необходимая граница ЦПД снижена до 60 мм рт.ст. [7]. Недавние исследования [3] показали, что поддержание уровня ЦПД ниже 50—60 мм рт.ст. ассоциировано с большим количеством положительных исходов, в то время как ЦПД более 70—80 мм рт.ст. чаще приводит к неблагоприятным исходам у пациентов с нарушенной АМК.
В классических работах N. Lundberg [8] выделены три вида спонтанных колебаний ВЧД: А-волны (плато), В- и С-волны. В последующих исследованиях было показано, что плато-волны отражают церебральную вазодилатацию, которая приводит к увеличению объемного мозгового кровотока и, как следствие, повышению ВЧД [9]. В настоящее время на анализе волновых колебаний артериального и внутричерепного давления основан один из наиболее надежных и безопасных методов непрерывной оценки ауторегуляции состояния мозговых сосудов в остром периоде тЧМТ — мониторинг коэффициента реактивности мозговых сосудов
(pressure reactivity index —
PRx
). PRx представляет собой коэффициент корреляции между медленноволновыми колебаниями АД и ВЧД [10, 11]. Показано, что плато-волны ВЧД при тЧМТ чаще регистрируются при сохранной ауторегуляции мозговых сосудов. В момент формирования плато-волн развивается максимальная вазодилатация артериол и ауторегуляция утрачивается, что регистрируется ростом PRx [12].
Ранее в экспериментальных исследованиях [13, 14] было показано, что повреждение определенных структур ствола мозга и гипоталамуса сопровождается развитием отека головного мозга. Электростимуляция отдельных структур ствола инициирует процессы, приводящие к церебральной вазодилатации и увеличению объемного мозгового кровотока [15, 16]. Предполагается, что ствол мозга может быть напрямую вовлечен в генерацию волн, характерных для внутричерепной гипертензии, однако анатомические пути и механизмы этого влияния до сих пор недостаточно изучены. В ряде экспериментальных работ показано влияние стимуляции отдельных структур ствола (в том числе голубоватого места — locus coeruleus) ретикулярной формации продолговатого мозга и полушарных структур мозга (в частности, передней поясной извилины и передних отделов гипоталамуса) на изменения ВЧД [17]. Также ранее было показано, что повреждение стволовых структур и лобных долей при ЧМТ может приводить к изменению активности симпатической нервной системы, влияющей на тонус артерий [18].
Особенностью ДАП является преимущественное повреждение подкорковых и стволовых структур мозга, участвующих в поддержании жизненно важных функций, в том числе регуляции церебрального сосудистого тонуса и АМК.
Цель настоящей работы — выявить анатомические повреждения глубинных структур мозга, оказывающие влияние на степень и длительность нарушений АМК в остром периоде тяжелого ДАП.
Общее понятие
В процессе изменений функциональной активности каждого органа и ткани, а также их метаболических потребностей происходит регуляция кровообращения. Физиология человеческого организма такова, что этот процесс осуществляется по трем основным направлениям.
Первым из способов подстроиться к меняющимся условиям является регуляция через сосудистую систему. Чтобы измерить этот показатель, проводится определение количества крови в определенный временной промежуток. Это, например, может быть минута. Этот показатель называется минутным объемом крови (МОК). Такое ее количество способно обеспечить потребности тканей в процессе метаболических реакций.
Вторым направлением обеспечения процессов регуляции является поддержание необходимого давления в аорте, а также прочих крупных артериях. Это движущая сила, которая обеспечивает достаточный в каждый конкретный момент приток крови. Причем она должна двигаться с определенной скоростью.
Третьим направлением является объем крови, который определяется в системных сосудах в данный момент времени. Он распределяется между всеми органами и тканями. При этом происходит определение их потребности в крови. Для этого учитывается их активность, функциональные нагрузки в данный момент. В такие периоды метаболические потребности тканей возрастают.
Регуляция кровообращения происходит под воздействием этих трех процессов. Они связаны неразрывно. В соответствии с этим происходит регуляция работы сердца, локального и системного кровотока.
Чтобы подсчитать МОК, потребуется определить количество крови, которое выбрасывает левый или правый сердечный желудочек в систему сосудов за минуту. В норме этот показатель составляет около 5-6 л/минуту. Возрастные особенности регуляции кровообращения сопоставляются с другими нормами.
Механизмы регуляции мозгового кровообращения и компенсации его нарушений
Регуляция мозгового кровообращения осуществляется сложной системой, включающей интра- и экстрацеребральные механизмы. Эта система способна к саморегуляции (т.е. может поддерживать кровоснабжение головного мозга в соответствии с его функциональной и метаболической потребностью и тем самым сохранять постоянство внутренней среды), что осуществляется путем изменения просвета мозговых артерий. Эти гомеостатические механизмы, развившиеся в процессе эволюции, весьма совершенны и надежны. Среди них выделяют следующие основные механизмы саморегуляции.
Нервный механизм
передает информацию о состоянии объекта регулирования посредством специализированных рецепторов, расположенных в стенках сосудов и в тканях. К ним, в частности, относятся механорецепторы, локализующиеся в кровеносной системе, сообщающие об изменениях внутрисосудистого давления (баро- и прессорецепторы), в том числе прессорецепторы каротидного синуса, при их раздражении расширяются мозговые сосуды; механорецепторы вен и мозговых оболочек, которые сигнализируют о степени их растяжения при увеличении кровенаполнения или объема мозга; хеморецепторы каротидного синуса (при их раздражении суживаются мозговые сосуды) и самой ткани мозга, откуда идет информация о содержании кислорода, углекислоты, о колебаниях рН и о других химических сдвигах в среде при накоплении продуктов метаболизма или биологически активных веществ, а также рецепторы вестибулярного аппарата, аортальной рефлексогенной зоны, рефлексогенные зоны сердца и коронарных сосудов, ряд проприорецепторов. Особенно велика роль синокаротидной зоны. Она оказывает влияние на мозговое кровообращение не только опосредовано (через общее АД), как это представлялось ранее, но и непосредственно. Денервация и новокаинизация этой зоны в эксперименте, устраняя сосудосуживающие влияния, ведет к расширению мозговых сосудов, к усилению кровоснабжения головного мозга, к повышению в нем напряжения кислорода.
Гуморальный механизм
заключается в прямом воздействии на стенки сосудов-эффекторов гуморальных факторов (кислорода, углекислоты, кислых продуктов метаболизма, ионов К и др.) путем диффузии физиологически активных веществ в стенку сосудов. Так, мозговое кровообращение усиливается при уменьшении содержания кислорода и (или) увеличении содержания углекислого газа в крови и, наоборот, ослабляется, когда содержание газов в крови меняется в противоположном направлении. При этом происходит рефлекторная дилятация или констрикция сосудов в результате раздражения хеморецепторов соответствующих артерий мозга при изменении содержания в крови кислорода и углекислоты. Возможен и механизм аксонрефлекса.
Миогенный механизм
реализуется на уровне сосудов-эффекторов. При их растяжении тонус гладких мышц возрастает, а при сокращении наоборот снижается. Миогенные реакции могут способствовать изменениям сосудистого тонуса в определенном направлении.
Разные механизмы регуляции действуют не изолировано, а в различных сочетаниях друг с другом. Система регулирования поддерживает постоянный кровоток в мозге на достаточном уровне и быстро изменяет его при воздействии различных «возмущающих» факторов.
Таким образом, понятие «сосудистые механизмы» включает структурные и функциональные особенности соответствующих артерий или их сегментов (локализацию в микроциркуляторной системе, калибр, строение стенок, реакции на различные воздействия), а также их функциональное поведение – специфическое участие в тех либо иных видах регуляции периферического кровообращения и микроциркуляции.
Выяснение структурно-функциональной организации сосудистой системы головного мозга позволило сформулировать концепцию о внутренних (автономных) механизмах регуляции мозгового кровообращения при различных возмущающих воздействиях. Согласно этой концепции, в частности, были выделены: «замыкательный механизм» магистральных артерий, механизм пиальных артерий, механизм регуляции оттока крови из венозных синусов мозга, механизм внутримозговых артерий. Суть их функционирования заключается в следующем.
«Замыкательный» механизм магистральных артерий поддерживает в мозге постоянство кровотока при изменениях уровня общего артериального давления. Это осуществляется путем активных изменений просвета мозговых сосудов – их сужения, увеличивающего сопротивление кровотоку при повышении общего АД и, наоборот, расширения, снижающего цереброваскулярное сопротивление при падении общего АД. Как констрикторные, так и дилятаторные реакции возникают рефлекторно с экстракраниальных прессорецепторов, либо с рецепторов самого мозга. Основными эффекторами в таких случаях являются внутренние сонные и позвоночные артерии. Благодаря активным изменениям тонуса магистральных артерий гасятся дыхательные колебания общего артериального давления, а также волны Траубе – Геринга, и тогда кровоток в сосудах мозга остается равномерным. Если же изменения общего АД очень значительны или механизм магистральных артерий несовершенен, вследствие чего нарушается адекватное кровоснабжение головного мозга, то наступает второй этап саморегуляции – включается механизм пиальных артерий, реагирующий аналогично механизму магистральных артерий. Весь этот процесс многозвеньевой. Основную роль в нем играет нейрогенный механизм, однако определенное значение имеют и особенности функционирования гладкомышечной оболочки артерии (миогенный механизм), а также чувствительность последней к различным биологически активным веществам (гуморальный механизм).
При венозном застое, обусловленном окклюзией крупных шейных вен, избыточное кровенаполнение сосудов головного мозга устраняется путем ослабления притока крови в его сосудистую систему вследствие констрикции всей системы магистральных артерий. В таких случаях регуляция происходит также рефлекторно. Рефлексы посылаются с механорецепторов венозной системы, мелких артерий и оболочек мозга (вено-вазальный рефлекс).
Система внутримозговых артерий представляет собой рефлексогенную зону, которая в условиях патологии дублирует роль синокаротидной рефлексогенной зоны.
Таким образом, согласно разработанной концепции, существуют механизмы, ограничивающие влияние общего АД на мозговой кровоток, корреляция между которыми во многом зависит от вмешательства саморегулирующихся механизмов, поддерживающих постоянство сопротивления мозговых сосудов (табл. 1). Однако саморегуляция возможна лишь в определенных пределах, ограниченных критическими величинами факторов, являющихся ее пусковыми механизмами (уровень системного АД, напряжения кислорода, углекислоты, а также рH вещества мозга и др.). В клинических условиях важно определить роль исходного уровня АД, его диапазона, в рамках которого мозговой кровоток сохраняет стабильность. Отношение диапазона этих изменений к исходному уровню давления (показатель саморегуляции мозгового кровотока) в
известной мере определяет потенциальные возможности саморегуляции (высокий или низкий уровень саморгеуляции).
Нарушения саморегуляции мозгового кровообращения возникают в следующих случаях.
1. При резком снижении общего АД, когда градиент давления в кровеносной системе мозга уменьшается настолько, что не может обеспечить достаточный кровоток в мозге (при уровне систолического давления ниже 80 мм рт. ст.). Минимальный критический уровень системного АД равен 60 мм рт. ст. (при исходном – 120 мм рт. ст.). При его падении мозговой кровоток пассивно следует за изменением общего АД.
2. При остром значительном подъеме системного давления (выше 180 мм рт. ст.), когда нарушается миогенная регуляция, так как мышечный аппарат артерий мозга утрачивает способность противостоять повышению внутрисосудистого давления, в результате чего расширяются артерии, усиливается мозговой кровоток, что чревато «мобилизацией» тромбов и эмболией. Впоследствии изменяются стенки сосудов, а это ведет к отеку мозга и резкому ослаблению мозгового кровотока, несмотря на то, что системное давление продолжает оставаться на высоком уровне.
3. При недостаточном метаболическом контроле мозгового кровотока. Так, иногда после восстановления кровотока в ишемизированном участке мозга концентрация углекислоты снижается, но рН сохраняется на низком уровне вследствие метаболического ацидоза. В результате сосуды остаются расширенными, а мозговой кровоток – высоким; кислород утилизируется не в полной мере и оттекающая венозная кровь имеет красный цвет (синдром избыточной перфузии).
4. При значительном снижении интенсивности насыщения крови кислородом или увеличении напряжения углекислоты в мозге. При этом активность мозгового кровотока также меняется вслед за изменением системного АД.
При срывах механизмов саморегуляции артерии мозга утрачивают способность к сужению в ответ на повышение внутрисосудистого давления, пассивно расширяются, вследствие чего избыточное количество крови под высоким давлением направляется в мелкие артерии, капилляры, вены. В результате повышается проницаемость стенок сосудов, начинается выход белков, развивается гипоксия, возникает отек мозга.
Таким образом, нарушения мозгового кровообращения компенсируются до определенных пределов за счет местных регуляторных механизмов. Впоследствии в процесс вовлекается и общая гемодинамика. Однако даже при терминальных состояниях в течение нескольких минут за счет автономности мозгового кровообращения в мозге поддерживается кровоток, а напряжение кислорода падает медленнее, чем в других органах, так как нервные клетки способны поглощать кислород при таком низком парциальном давлении его в крови, при котором другие органы и ткани поглощать его не могут. По мере развития и углубления процесса все более нарушаются взаимоотношения между мозговым кровотоком и системной циркуляцией, иссякает резерв ауторегулирующих механизмов, и кровоток в мозге все больше начинает зависеть от уровня общего АД.
Таким образом, компенсация нарушений мозгового кровообращения осуществляется при помощи тех же, функционирующих в нормальных условиях, регуляторных механизмов, но более напряженных.
Для механизмов компенсации характерна двойственность: компенсация одних нарушений вызывает другие циркуляторные расстройства, например, при восстановлении кровотока в ткани, испытавшей дефицит кровоснабжения, в ней может развиться постишемическая гиперемия в виде избыточной перфузии, способствующей развитию постишемического отека мозга.
Конечной функциональной задачей системы мозгового кровообращения являются адекватное метаболическое обеспечение деятельности клеточных элементов мозга и своевременное удаление продуктов их обмена, т.е. процессы, протекающие в пространстве микрососуд – клетка. Все реакции мозговых сосудов подчинены этим главным задачам. Микроциркуляция в головном мозге имеет важную особенность: в соответствии со спецификой его функционирования активность отдельных областей ткани меняется почти независимо от других областей ее, поэтому микроциркуляция также меняется мозаично – в зависимости от характера функционирования мозга в тот или иной момент. Благодаря ауторегуляции перфузионное давление микроциркуляторных систем любых частей мозга менее зависит от центрального кровообращения в других органах. В мозге микроциркуляция усиливается при повышении уровня метаболизма и, наоборот. Те же механизмы функционируют и в условиях патологии, когда имеет место неадекватность кровоснабжения ткани. При физиологических и патологических условиях интенсивность кровотока в микроциркуляторной системе зависит от величины просвета сосудов и от реологических свойств крови. Однако регулирование микроциркуляции осуществляется в основном путем активных изменений ширины сосудов, в то же время при патологии важную роль играют также изменения текучести крови в микрососудах.
Движение крови
Регуляция мозгового кровообращения, а также всех органов и тканей организма происходит посредством движения крови по сосудам. Вены, артерии и капилляры имеют определенный диаметр и длину. Они практически не меняются под воздействием разных факторов. Поэтому регулировка движения крови происходит посредством изменения ее скорости. Она движется благодаря работе сердца. Этот орган создает разность давления между началом и концом русла сосудов. Как и все жидкости, кровь движется из области высокого в область низкого давления. Эти крайние точки находятся в определенных участках тела. Наиболее высокое давление определяется в аорте и легочных артериях. Когда кровь проходит через весь организм, она возвращается обратно к сердцу. Наиболее низкое давление при этом определяется в полых (нижняя, верхняя) и легочных венах.
Давление падает постепенно, так как много энергии тратится на проталкивание крови по капиллярным протокам. Также кровоток в процессе движения испытывает сопротивление. Оно определяется диаметром просвета кровеносных сосудов, а также вязкостью самой крови. Движение становится возможным благодаря еще нескольким причинам. Среди них основными являются:
- в венах есть клапаны, что препятствует обратному перемещению жидкости;
- разное давление в сосудах в начальной и конечной точке;
- существование присасывающей силы при вдохе;
- движение скелетных мышц.
Механизмы регуляции кровообращения принято разделять на местные и центральные. В первом случае этот процесс происходит в органах, местных тканях. В этом случае учитывается, как нагружен орган или отдел, сколько кислорода ему требуется для правильной работы. Центральная регуляция проводится под воздействием общих адаптивных реакций.
Обсуждение
Предложенная нами гипотеза о влиянии определенных нейромедиаторных структур мозга в качестве центральных звеньев на АМК при тяжелой травме мозга ранее не была освещена в литературе. Полученные нами данные на модели ДАП могут быть объяснены накопленными ранее результатами изучения других заболеваний мозга человека (главным образом, нейродегенеративных) и предшествовавшими экспериментальными работами.
В настоящее время доказано, что многие нейромедиаторные системы могут оказывать влияние на кровоток посредством рецепторов, находящихся на капиллярах или периваскулярной глии. Такие эффекты, в частности, показаны для дофамина, у которого существует два типа рецепторов: D1- и D2-подобные рецепторы, первые из которых обладают вазорелаксирующим, а вторые — вазоконстрикторным эффектами. Дофамин у человека оказывает сужающее действие на крупные мозговые артерии и тем самым увеличивает линейную скорость мозгового кровотока [26].
Черная субстанция функционально относится к экстрапирамидной системе, поскольку участвует в регуляции мышечного тонуса при обеспечении двигательных функций. Наименее известны и изучены анатомические пути, посредством которых она влияет на вегетативные функции: дыхание, сердечную деятельность и тонус сосудов. Черная субстанция содержит два вида нейронов, одни из которых используют дофамин (pars compacta
), а другие (
pars reticulata
) — глутамат. В ряде экспериментальных работ показано, что электрическая стимуляция
pars compacta
черной субстанции вызывает тахикардию и повышение артериального давления [25, 27—29]. Подобные данные указывают на то, что дофаминергические нейроны черной субстанции активируют центральный путь кардиоваскулярного депрессорного центра, посредством которого происходит ингибирование симпатических волокон, вызывающих сужение артерий и учащение сердцебиения.
Дофаминергические нейроны черной субстанции посылают проекции к системе базальных отделов переднего мозга, получившей название «расширенной миндалины». «Расширенная миндалина» тесно связана со структурами переднего мозга и ствола, вовлеченными в регуляцию сердечно-сосудистой системы [29, 30]. Стимуляция ее структур так же, как и стимуляция черной субстанции, приводит к подавлению кардиоваскулярных реакций [31, 32], что позволяет объединить их в единую регуляторную систему. Ранее проведенные исследования показали, что активность дофаминергических нейронов черной субстанции может регулироваться артериальными барорецепторами [33, 34]. Денервация барорецепторов приводит к снижению продукции и высвобождения дофамина в стриатум. Эти данные указывают на важный факт, что дофаминергические нейроны черной субстанции могут явиться частью длинного центрального барорецепторного рефлекторного пути, регулирующего уровень АД [35].
Существуют доказательства, что холинергические нейроны также участвуют в регуляции регионального мозгового кровотока [36, 37], причем этот механизм регуляции не зависит от регионарного метаболизма и системного А.Д. Активация холинергических волокон ядра Мейнерта и септального комплекса приводит к высвобождению ацетилхолина в коре и гиппокампе, что провоцирует увеличение мозгового кровотока в данных структурах. Диффузное увеличение кровотока в коре во время ходьбы ассоциировано с возбуждением вазодилатирующей системы базального ядра Мейнерта [36]. Активация холинергических нейронов базальных отделов переднего мозга может вносить вклад в повышение ВЧД и формирование плато-волн за счет вазодилатации [17].
Известно, что при ряде нейродегенеративных заболеваний головного мозга (болезнь Паркинсона, мультисистемная атрофия) также отмечаются нарушения ауторегуляции, что связывается с вегетативной дисфункцией [38]. Однако каждое звено вегетативной системы имеет свое представительство в ЦНС, в частности в стволе головного мозга. Клинической моделью для понимания роли черной субстанции в регуляции кровотока является болезнь Паркинсона — заболевание, характеризующееся прогрессирующей утратой дофаминергических нейронов черной субстанции. Экспериментальные работы, моделирующие данное заболевание, указывают на ослабление симпатического компонента регуляции АД и сердечного ритма при дегенерации черной субстанции [39].
Таким образом, в настоящей работе показано, что повреждение дофаминергической структуры черной субстанции и холинергической структуры области ядра Мейнерта у пациентов с ДАП ассоциировано с более выраженным и длительным нарушением ауторегуляции мозгового кровотока. Полученные данные указывают на существование у человека нейрогенных механизмов регуляции тонуса мозговых сосудов, вносящих вклад в изменение ВЧД. Повреждение этих регуляторных звеньев в результате травмы сопряжено с более тяжелым и длительным периодом нарушенной ауторегуляции мозгового кровотока, что может потребовать более продолжительного мониторинга и коррекции ВЧД.
Результаты работы показывают наличие различных паттернов повреждения мозга у пациентов с нарушенными и сохранными механизмами церебральной ауторегуляции при одинаковой тяжести и клинической форме ЧМТ. Полученные нами данные, с клинической стороны, косвенно подтверждают результаты ранее проведенных экспериментальных исследований относительно наличия прямых нейрональных механизмов регуляции тонуса сосудов. Однако эти данные следует интерпретировать с осторожностью, они являются предварительными и лишь приоткрывают завесу сложных механизмов регуляции мозгового кровотока при острой патологии мозга. Безусловно, необходимы дальнейшие, более развернутые исследования в данном направлении, в том числе для идентификации всех звеньев нейрональной регуляторной системы.
Работа поддержана грантом РФФИ № 16−04−01472.
Авторы заявляют об отсутствии конфликта интересов.
Местная регуляция
Если рассматривать регуляцию кровообращения кратко, можно отметить, что этот процесс происходит как на уровне отдельных органов, так и в целом в организме. Они имеют несколько отличий.
Кровь приносит клеткам кислород и уносит из них отработанные элементы их жизнедеятельности. Процессы местного регулирования связаны с поддержанием базального тонуса сосудов. В зависимости от интенсивности метаболизма в конкретной системе этот показатель может меняться.
Стенки сосудов покрыты гладкими мышцами. Они никогда не пребывают в расслабленном состоянии. Это напряжение называется мышечным тонусом сосудов. Он обеспечивается двумя механизмами. Это миогенная и нейрогуморальная регуляция кровообращения. Первый из названных механизмов является главным при поддержании тонуса сосудов. Даже если абсолютно отсутствуют внешние влияния на систему, остаточный тонус все равно сохраняется. Он получил название базального.
Этот процесс обеспечивается спонтанной активностью клеток гладких мышц сосудов. Это напряжение передается по системе. Каждая клетка передает другой возбуждение. Это провоцирует возникновение ритмических колебаний. Когда мембрана становится гиперполяризированной, спонтанные возбуждения исчезают. При этом исчезают и сокращения мышц.
В процессе метаболизма в клетках вырабатываются вещества, которые оказывают активное влияние на гладкие мышцы сосудов. Этот принцип называется обратной связью. Когда тонус прекапиллярных сфинктеров возрастает, кровоток в таких сосудах снижается. Концентрация продуктов метаболизма возрастает. Они способствуют расширению сосудов, увеличению кровотока. Этот процесс повторяется циклично. Он относится к категории местной регуляции кровообращения в органах и тканях.
Результаты
Данные анализа МРТ показали, что у всех пациентов анализируемой выборки отмечались признаки диффузного повреждения мозга с вовлечением полушарных и у 29 (78,4%) из 37 пациентов — стволовых структур. Вместе с тем небольшая численность пациентов в группах с сохранной и нарушенной ауторегуляцией не позволила выявить достоверные отличия в исходах по ШИГ тяжести травмы по ШКГ. Группы не отличались между собой по половозрастным характеристикам. Локализация и глубина повреждений мозга, оцененных по классификациям Р. Фиршинга и соавт. [22] и Н.Е. Захаровой и соавт. [23], также значимо не различалась между группами сравнения (см. табл. 1).
Распространенность повреждения стволовых и подкорковых структур мозга при нарушенной АМК
Далее был проведен статистический анализ частоты встречаемости одно- или двустороннего повреждения каждой структуры мозга у пациентов с нарушенной (2-я группа) и сохранной (1-я группа) ауторегуляцией (табл. 2).
Таблица 2. Частота одно- и/или двустороннего повреждения структур мозга у пациентов с нормальной и нарушенной ауторегуляцией Примечание. * — достоверные различия между группами.
Статистический анализ данных показал, что у пациентов с травматическим повреждением мозга, сопровождающимся нарушениями АМК в остром периоде травмы, в целом повреждения ствола отмечались несколько чаще, чем в группе пациентов с нормальной ауторегуляцией. Среди изученных стволовых структур значительно чаще (р
=0,02) у пациентов 2-й группы отмечалось структурное повреждение черной субстанции среднего мозга — структуры, являющейся источником дофаминергических проекций для неостриатума, поясной коры, обонятельных ядер, заднего гипоталамуса и миндалин мозга. Отношение шансов составило 5,333 (95% ДИ 1,252; 29,346), чувствительность 62,5% и специфичность 76,2%. Также выявлено более частое повреждение холинергической структуры – области ядра Мейнерта у пациентов с нарушенной ауторегуляцией (
р
=0,01), причем одно- или двустороннее повреждение этой области мозга имело достаточно высокую специфичность (81%) для пациентов данной группы. Дополнительно была оценена частота встречаемости сочетанного повреждения черной субстанции и ядра Мейнерта, которая значимо преобладала в группе с нарушенной ауторегуляцией (
р
=0,02). Отношение шансов составило 7,39 (95% ДИ 1,043; 65,37), чувствительность 43,8% и специфичность 90,5%.
Таким образом, анализ показал, что нарушение ауторегуляции мозгового кровотока у пациентов с ДАП головного мозга часто ассоциировано с наличием первичного повреждения черной субстанции, области ядра Мейнерта и их сочетанием (рис. 2).
Рис. 2. МРТ головного мозга пациентов с тяжелой ЧМТ с повреждением структур черной субстанции (а), области ядра Мейнерта (б), сочетанным повреждением черной субстанции и области ядра Мейнерта (в). Повреждения указаны стрелками.
Распространенность повреждения подкорковых и стволовых структур мозга при длительном нарушении ауторегуляции
Для анализа влияния повреждения подкорковых и стволовых структур мозга на параметр ауторегуляции кровотока (PRx) пациенты были разделены на три примерно равные по численности группы в зависимости от длительности периода утраченной ауторегуляции (PRx>0,2) относительно всего времени измерения: 1) менее 20% времени (n
=17); 2) 20—34% времени (
n
=10); 3) 35% времени и более (
n
=10). Результаты данного анализа представлены в табл. 3.
Таблица 3. Частота повреждения структур мозга у пациентов с разной длительностью нарушения ауторегуляции (в процентном отношении к длительности измерения ВЧД) Примечание. * — различия между 1-й и 3-й группами; # — различия между 2-й и 3-й группами.
Выявлено, что у пациентов с утраченной ауторегуляцией более 35% времени измерения несколько чаще присутствовало повреждение ствола. В этой группе пациентов значительно чаще встречались повреждения черной субстанции (р
=0,05). Отношение шансов составило 5,6 (95% ДИ 0,785; 45,938), чувствительность и специфичность составили 70 и 70,6% соответственно. Также в данной группе отмечено более частое повреждение области ядра Мейнерта (
р
=0,04). Отношение шансов составило 7,6 (95% ДИ 1,006; 68,466), чувствительность и специфичность составили 70 и 76,5% соответственно.
Согласно результатам данного анализа, сохранились значимые различия в частоте повреждения черной субстанции, области ядра Мейнерта и их сочетания между крайними группами (при длительности нарушенной ауторегуляции менее 20% и более 35% времени измерения). Таким образом, наличие первичного повреждения ствола в области черной субстанции и базальных отделов переднего мозга (область ядра Мейнерта) вносит существенный вклад в нарушение механизмов АМК.
Местная и центральная регуляция
Механизмы регуляции органного кровообращения подчиняются двум взаимосвязанным факторам. С одной стороны, в организме существует центральная регуляция. Однако для ряда органов с высоким показателем метаболических процессов этого недостаточно. Поэтому здесь ярко выражены местные механизмы регуляции.
К таким органам относятся почки, сердце и мозг. В тех тканях, которые не отличаются высоким уровнем метаболизма, подобные процессы выражены меньше. Местные механизмы регуляции необходимы для поддержания стабильной скорости и объема кровотока. Чем более ярко выражены процессы метаболизма в органе, тем больше он нуждается в поддержании стабильного притока и оттока крови. Даже при колебаниях давления в системном кровотоке, в этих участках организма поддерживается его стабильный уровень.
Однако местный механизм регуляции является все же недостаточным для обеспечения быстрого изменения притока и оттока крови. Если бы в организме существовали бы только эти процессы, они бы не смогли обеспечить правильное, своевременное приспособление к меняющимся внешним условиям. Поэтому местная регуляция обязательно добавляется процессами центральной нейрогуморальной регуляцией кровообращения.
Нервные окончания отвечают за процессы иннервации сосудов и сердца. Рецепторы, которые присутствуют в системе, реагируют на разные показатели крови. К первой категории относятся нервные окончания, которые реагируют на изменения давления в русле. Их называют механорецепторами. Если же меняется химический состав крови, на это реагируют другие нервные окончания. Это хеморецепторы.
Механорецепторы реагируют на растяжение стенок сосудов и изменение скорости перемещения в них жидкости. Они способны отличать колебания нарастающего давления или пульсовые рывки.
Единое поле нервных окончаний, которое расположено в сосудистой системе, составляют ангиорецепторы. Они скапливаются в определенных участках. Это рефлексогенные зоны. Они определяются в синокаротидной, аоральной области, а также в сосудах, которые сконцентрированы в легочном круге обращения крови. При повышении давления механорецепторы создают залп из импульсов. Они исчезают при понижении давления. Порог возбуждения механорецепторов составляет от 40 до 200 мм рт. ст.
Хеморецепторы реагируют на повышение или понижение концентрации гормонов, питательных веществ внутри сосудов. Они передают сигналы о собранной информации в центральную нервную систему.
Материал и методы
В анализ включены 37 пациентов с тЧМТ (3—8 баллов по шкале комы Глазго), находившихся на лечении в отделении реанимации НМИЦ нейрохирургии им. Н.Н. Бурденко в период с 2009 по 2014 г. Критериям включения соответствовали пациенты, которые по клиническим показаниям требовали мониторинга АД, ВЧД, ЦПД и у которых при выполнении МРТ головного мозга были выявлены признаки ДАП. Данные мониторинга сохранялись, анализировались и рассчитывались с помощью программного обеспечения ICM Plus. Всего в анализ включены 23 мужчины, 12 женщин, средний возраст которых составил 28±12,4 года. Семи пациентам данной группы была проведена декомпрессивная трепанация черепа в связи с диффузным отеком головного мозга.
В отделении реанимации и интенсивной терапии больным проводились ИВЛ, РаСО2 поддерживалось на уровне 35—45 мм рт.ст., РаО2 — не ниже 100 мм рт.ст., проводилась седация, аналгезия (пропофол 1—3 мг/кг/ч или мидазолам 10—30 мкг/кг/ч, фентанил 1—2 мкг/кг/ч). ЦПД поддерживалось выше 60 мм рт.ст. При ВЧД выше 20 мм рт.ст. использовали болюсное введение 15% маннитола (0,25—1 г/кг) или Гиперхаеса в дозе 2—3 мл/кг.
Для оценки глубины комы использовалась шкала комы Глазго (ШКГ) [19, 20]. Исходы ЧМТ оценивали по шкале исходов Глазго (ШИГ) [20, 21]. Повреждения мозга при ДАП оценивались по классификации, основанной на данных МРТ [22]. Локализация и уровень повреждения мозга оценивались по МРТ-классификации, предложенной Н.Е. Захаровой и соавт. [23].
Всем пациентам проводился мониторинг ВЧД согласно международным рекомендациям и протоколу ассоциации нейрохирургов РФ [7, 24]. Мониторинг ВЧД проводился с помощью монитора ICP Express Monitor Codman и датчика Codman MicroSensor («Jonson&Jonson Professional, Inc.», Raynham, США). Датчик ВЧД имплантировался в белое вещество мозга через трефинационное отверстие в проекции точки Кохера в премоторную зону субдоминантного полушария. Оценка АМК выполнялась с помощью мониторинга показателя реактивности мозговых сосудов PRx [10]. Длительность мониторинга PRx в среднем составила 7 сут. Оценивали также соотношение длительности периода нарушенной ауторегуляции к общей продолжительности мониторинга этого параметра.
Мониторинг АД проводился с помощью прямого измерения через артериальный катетер, установленный в лучевой, бедренной артериях или в тыльной артерии стопы.
На основании расчета среднего коэффициента PRx за весь период наблюдения при мониторировании ВЧД и ЦПД было выделено две группы пациентов:
1-я группа
— с сохранной АМК — PRx [–1; 0];
2-я группа
— с частично или полностью утраченной АМК — PRx (0; 1].
Характеристика пациентов каждой группы представлена в табл. 1.
Таблица 1. Сравнительный анализ групп с сохранной и нарушенной АМК Примечание. Условные сокращения: ШКГ — шкала комы Глазго, ШИГ — шкала исходов Глазго, ДАП — диффузное аксональное повреждение, ВЧД — внутричерепное давление, ВЧГ — внутричерепная гипертензия, PRx — коэффициент реактивности мозговых сосудов. 1-ю группу составили 19 пациентов. У 16 (84,2%) из них причиной травмы было ДТП. У 15 (78,9%) пациентов при проведении МРТ было диагностировано повреждение ствола головного мозга.
2-я группа представлена 18 пациентами. У 15 из них причиной травмы было ДТП. Семи пациентам проведена декомпрессивная трепанация в связи с диффузным отеком головного мозга. У 15 (83,3%) пациентов этой группы при проведении МРТ визуализировалось повреждение ствола головного мозга.
Методы нейровизуализации.
МРТ головного мозга проводилось на 3 Т томографе GE в стандартных режимах (T1, T2, FLAIR) и режимах SWI/Т2* GRE, DWI, что позволило оценить как ишемические, так и мелкие геморрагические очаговые повреждения. У каждого пациента, по данным МРТ, было оценено повреждение отдельных подкорковых структур и зон ствола головного мозга, являющихся проекциями основных нейромедиаторных систем мозга (рис. 1),
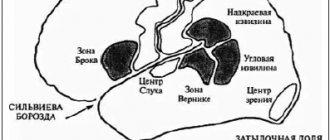
Рис. 1. Расположение структур мозга, включенных в факторный анализ. NC — хвостатое ядро, Put — скорлупа, GPi — внутренний сегмент бледного шара, GPe — наружный сегмент бледного шара, Tha — таламус, SN — черная субстанция, VTA — вентральная покрышечная область, MN — ядро Мейнерта, LDT — латеродорзальное ядро покрышки, PPN — педункулопонтийное ядро, NR — красное ядро, LC — голубоватое место. Красным цветом выделены дофаминергические, синим — норадренергические, зеленым — холинергические, оранжевым — глутаматергические, фиолетовым — ГАМКергические структуры мозга. а также области поражения лобных долей (медиобазальные, полюсные и дорзолатеральные отделы).
Статистические методы.
Обработка данных проведена в пакете программ Statistica 8.0. («StatSoft Inc», США). Во всех случаях для статистической оценки были использованы непараметрические критерии. Для анализа качественных признаков применялся критерий Фишера (
F
), для оценки влияния анатомических факторов на риск развития нестабильной гемодинамики рассчитывались отношения шансов, чувствительность и специфичность каждого фактора. Результаты считались статистически значимыми при
р
<0,05.
Центральные механизмы
Центр регуляции кровообращения регулирует величину выброса из сердца, а также тонус сосудов. Этот процесс происходит за счет общей работы нервных структур. Их еще называют вазомоторным центром. Он включает в себя разные уровни регуляции. Причем здесь прослеживается четкая иерархическая подчиненность.
Центр регуляции кровообращения находится в гипоталамусе. Подчиненные структуры вазомоторной системы находятся спинном и головном мозге, а также в коре больших полушарий. Существует несколько уровень регуляции. Они имеют размытые границы.
Спинальный уровень представляет собой нейроны, которые находятся в поясничном и боковых рогах грудного отдела спинного мозга. Аксоны этих нервных клеток формируют волокна, суживающие сосуды. Их импульсы поддерживаются лежащими выше структурами.
Бульбарный уровень представляет собой сосудодвигательный центр, который расположен в продолговатом мозге. Он размещен на дне 4-го желудочка. Это основной центр регуляции процесса кровообращения. Он разделяется на прессорную, депрессорную части.
Первая из названных зон отвечает за повышение давления в русле. Вместе с этим увеличиваются частота, сила сокращений сердечной мышцы. Это способствует повышению МОК. Депрессорная зона выполняет противоположную функцию. Она снижает давление в артериях. При этом деятельность сердечной мышцы также уменьшается. Рефлекторно этот участок оказывает торможение нейронов, которые относятся к прессорной зоне.
Лечение и профилактика нарушений мозгового кровообращения
Инсульт – одна из ведущих причин смерти и наиболее распространенная причина инвалидности.
Профилактика инсульта включает:
- Своевременную диагностику и терапию диабета.
- Лечение артериальной гипертензии: ограничение натрия, регулярный прием препаратов для снижения давления.
- Контроль уровня холестерина в крови: правильное питание, снижение веса, применение статинов.
- Диагностику и выявление причин транзиторных ишемических атак (ТИА).
- Избегание стрессов и психо-эмоциональных перегрузок.
- Своевременная диагностика и лечение атеросклероза сосудов.
- Соблюдение режима сна и физической активности.
- Подбор диеты.
- Укрепление стенок сосудов, как лекарственными препаратами, так и профилактическими мероприятиями – закаливание, гимнастика, прием антиоксидантов и витаминов.
- Избавление от курения.
Адекватная терапия нарушений мозгового кровообращения начинается с обследования и установления точной причины патологии. Нельзя заниматься самолечением и бессистемно сбивать давление – это нарушает скоординированную работу сердечно-сосудистой системы, повышает нагрузку на стенки сосудов, что приводит к образованию аневризм, стенозов и как следствие, нарушению почечной фильтрации, усугубляя тем самым течение гипертонической болезни, повышая риск инсультов и инфарктов. При нерегулярном и неправильно приеме гипотензивных средств, падает церебральное перфузионное давление, что вызывает закупорку кровеносных сосудов и гипоксию мозга. Присутствие малейших симптомов нарушения МК – повод незамедлительно обратиться к врачу.
К большому сожалению, на фоне постоянных стрессов, неправильного питания, несвоевременного обследования, бесконтрольного приема лекарственных средств, нарушение мозгового кровообращения стало поражать людей молодого возраста. Иногда, частые головные боли могут свидетельствовать о начале изменений в сосудах головного мозга, в связи, с чем прием обезболивающих средств может затруднять своевременную диагностику и приводить к осложнениям.
Начальное обследование кровоснабжения головного мозга должно включать:
- Клинический анализ крови
- Общий анализ мочи
- Биохимический анализ крови, в частности липидный профиль с определением индекса атерогенности, определение глюкозы крови
- Коагулограмма
- УЗИ брахицефальных и транскраниальных сосудов шеи и головного мозга
- УЗИ сердца (ЭХО-КГ)
- УЗИ почек и области надпочечников
- Измерение антропометрических данных и вычисление индекса массы тела
- Консультация офтальмолога, с обязательным исследованием сосудов глазного дна
- Консультация кардиолога
- Консультация невролога
Это обязательный перечень для базового исследования для определения рисков или степени нарушения мозгового кровообращения, но врач на основании полученных данных осмотра, анамнеза и результатов исследований может порекомендовать более глубокие обследования, вплоть до КТ и МРТ, для установки степени тяжести состояния, установки правильного диагноза и подбора лечебно-профилактических мероприятий.
Для более подробной консультации, осмотра и обследований обращайтесь к специалистам медицинского .
Другие уровни регуляции
Нервно-гуморальная регуляция кровообращения обеспечивается работой и других уровней. Они занимают в системе иерархии более высокое положение. Так, на сосудодвигательный центр оказывает воздействие гипоталамический уровень регуляции. Это влияние имеет нисходящий характер. В гипоталамусе также различаются прессорная и депрессорная зоны. Это можно рассматривать как дубликат бульбарного уровня.
Существует также корковый уровень регуляции. В коре головного мозга есть зоны, которые оказывают нисходящее воздействие на центр, расположенный в продолговатом мозге. Этот процесс является результатом сопоставления данных, поступивших от высших рецепторных зон на основе информации различных рецепторов. Это формирует реализацию поведенческих реакций, сердечно-сосудистого компонента эмоций.
Перечисленные механизмы формируют центральное звено. Однако существует и еще один механизм нейрогуморальной регуляции. Он называется эфферентным звеном. Все части этого механизма вступают в сложное взаимодействие между собой. Они состоят из разных компонентов. Их взаимосвязь позволяет регулировать кровоток в соответствии с существующими потребностями организма.
Артериальное кровоснабжение
Особенностью мозгового кровообращения является высокая интенсивность и практически постоянный объем крови, который в пределах черепной коробки составляет около 75 мл. Больше 20% крови при сердечном сокращении поступает в ткани мозга. Анатомия артерий, пролегающих в головном мозге, представлена элементами:
- Каротидная система. Бассейн сформирован сонными артериями, идущими параллельно. Сонная артерия разделяется на ветви. Каротидный кровоток – быстрый и прямой.
- Вертебрально-базилярная система. Бассейн создан позвоночными и базилярной артериями. Вертебрально-базилярный кровоток – медленный.
- Виллизиев круг. Обеспечивает насыщение кровью участков большого мозга. Круг образован ветвями сонной артерии, которые питают лобные, теменные, височные доли.
- Круг Захарченко. Пролегает в пределах внутренней поверхности отдела продолговатого мозга. Контур сформирован двумя парами артерий: позвоночными и передними спинномозговыми.
Стенки мелких артерий, пролегающих в голове и шее, трехслойные. Они состоят из слоев – внутреннего (эндотелий), среднего (гладкая мускулатура) и наружного (соединительная ткань). Круг полного кровообращения совершается за 4-5 секунд.
Нервный механизм
Нервная регуляция кровообращения является частью эфферентного звена глобальной системы, которая управляет этими процессами. Этот процесс осуществляется за счет трех компонентов:
- Симпатические преганглионарные нейроны. Расположены в поясничном отделе и передних рогах спинного мозга. Также они определяются в симпатических ганглиях.
- Парасимпатические преганглионарные нейроны. Это ядра блуждающего нерва. Они находятся в продолговатом мозгу. Также сюда относятся ядра тазового нерва, который находится в крестцовом отделе спинного мозга.
- Эфферентные нейроны метасимпатической нервной системы. Они нужны для полых органов висцерального типа. Эти нейроны находятся в ганглиях интрамурального типа их стенок. Это конечный путь, по которому продвигаются центральные эфферентные влияния.
Практически все сосуды подлежат иннервации. Это нехарактерно только для капилляров. Иннервация артерий соответствует иннервации вен. Во втором случае плотность нейронов меньше.
Нервно-гуморальная регуляция кровообращения четко прослеживается до самых сфинктеров капилляров. Они оканчиваются на клетках гладких мышц этих сосудов. Нервная регуляция капилляров проявляется в виде эфферентной иннервацией посредством свободной диффузии метаболитов, направленных к стенкам сосудов.
Венозная система
Вены отличаются тонкими стенками малой эластичности и упругости. Мышечный слой развит слабо. В крупных венах находятся клапаны, благодаря которым кровь движется в одном направлении – к сердцу. Схема кровоснабжения участков головного мозга включает венозные синусы – каналы, пролегающие между долями мозговой оболочки.
Синусы участвуют в процессе реабсорбции (обратное всасывание) ликвора – спинномозговой жидкости, из субарахноидального (расположенного между мягкой и паутинной мозговой оболочкой) пространства. Отток венозной крови при повышении внутричерепного давления осуществляется через эмиссарные и диплоические вены. Венозная кровь – темная. В ней содержится углекислый газ и продукты метаболизма, практически отсутствует кислород.
Эндокринная регуляция
Регуляция системы кровообращения может выполняться посредством эндокринных механизмов. Главную роль в этом процессе играют гормоны, которые вырабатываются в мозге и корковых слоях надпочечников, гипофизом (задней доле), юкстагломерулярным почечным аппаратом.
Сосудосуживающее воздействие оказывает адреналин на артерии кожи, почек, органов пищеварения, легких. При этом это же вещество способно производить и обратное действие. Адреналин расширяет сосуды, которые проходят в мышцах скелета, в гладких мышцах бронхов. Этот процесс способствует перераспределению крови. При сильном возбуждении, переживаниях, напряжении кровоток усиливается в скелетных мышцах, а также в сердце и мозге.
Норадреналин также оказывает воздействие на сосуды, позволяя перераспределять кровь. При повышении уровня этого вещества на него реагируют специальные рецепторы. Они могут быть двух типов. Обе разновидности присутствуют в сосудах. Они контролируют процесс сужения или расширения протока.
Рассматривая физиологию регуляции кровообращения, следует рассмотреть и другие вещества, которые влияют на весь процесс. Одним из них является альдостерон. Он вырабатывается надпочечниками. Он влияет на чувствительность стенок сосудов. Этот процесс контролируется при помощи изменения всасывания натрия почками, слюнными железами, а также органами ЖКТ. Сосуды становятся больше или меньше подвержены воздействию адреналина и норадреналина.
Такое вещество, как вазопрессин, способствует сужению стенок артерий в легких и в органах брюшины. При этом сосуды сердца и мозга реагируют на это расширением. Вазопрессин также выполняет функцию перераспределения крови в организме.
Функции артерий
Здоровые артерии обеспечивают нормальное кровоснабжение участков мозга. По артериям движется кровь, насыщенная кислородом. Артериальная кровь отличается ярким, алым цветом. Основная функция артериальной сети – доставка кислорода, питательного субстрата к органам, тканям и клеткам. Если по каким-либо причинам проходимость артерий нарушается, развивается состояние гипоксии (кислородного голодания), которое провоцирует ишемию, некроз (отмирание) тканей, инсульт, инфаркт мозга.
Признаки, причины и методы лечения нарушения кровоснабжения, которое произошло в тканях спинного мозга и мозговых отделах головы, изучает раздел медицины – неврология. Поражение отдельных элементов системы мозгового кровотока не всегда проявляется выраженной симптоматикой.
Благодаря высоким компенсаторным способностям происходит естественная регуляция процессов кровоснабжения. Научно доказано, чтобы проявились гемодинамические и неврологические расстройства, сосудистый просвет крупной магистрали должен сузиться больше, чем на 50% на фоне сужения многих артерий в пределах одного бассейна. Основные причины расстройства функции кровоснабжения:
- Окклюзии (нарушение проходимости) элементов артериального и венозного контуров.
- Аневризма. Патологическое расширение участка артерии на фоне утраты способности к восстановлению прежней формы.
- Тромбозы. Частичная или полная закупорка сосудистого просвета кровяным сгустком или холестериновой бляшкой.
Патологические изменения и деформации сосудистых стенок могут быть врожденными или приобретенными. Аномальные варианты развития артериальной сети встречаются часто и не всегда сопровождаются сбоями в работе системы кровообращения. Приобретенные возникают как следствие влияния факторов:
- инфекционные заболевания – энцефалит, абсцесс, менингит;
- черепно-мозговые травмы;
- поражения сердечно-сосудистой системы;
- хронические стрессы;
- ожирение, нарушения в работе эндокринной системы;
- артериальная гипертензия;
- остеохондроз, заболевания позвоночника.
Специфика симптомов показывает, в каком отделе мозга произошли нарушения. Патологические изменения в передней артерии сопровождаются двигательной дисфункцией. Признаки – расстройство крупной и мелкой моторики, аномальная походка, нарушение мимики, жестов, речи, свойственное для моторной афазии. Нарушенный кровоток в средней артерии приводит к брахиофациальному типу пареза (частичный паралич) и гемигипестезии – снижению чувствительности отдельных участков тела.
Поражение тканей ствола сонной артерии проявляется гемианопсией (двусторонней слепотой на отдельном участке поля зрения), расстройствами психо-эмоциональной сферы, ухудшением способности к концентрации внимания, нарушением функций памяти и мелкой моторики. Тотальными патологиями грозят деформации стенок и структур базилярной артерии. Выражаются синдромом Филимонова – тетраплегией (частичный или полный паралич конечностей) при сохранении сознания и функции движения глаз.
Прочие компоненты эндокринной регуляции
Регуляция кровообращения эндокринного типа возможна при участии и иных механизмов. Один из них обеспечивает такое вещество, как ангиотензин-II. Он образуется в процессе расщепления ферментами ангиотензина-I. На этот процесс влияет ренин. Это вещество отличается сильным сосудосуживающим действием. Причем оно значительно мощнее, чем последствия выброса в кровь норадреналина. Однако, в отличие от этого вещества, ангиотензин-II не провоцирует выброс крови из депо.
Такое действие обеспечивается за счет присутствия чувствительных к веществу рецепторов только в артериолах при входе в капилляры. Они расположены в кровеносной системе неравномерно. Это объясняет неоднородность воздействия представленного вещества в разных участках организма. Так, снижение кровотока при повышении концентрации ангиотензина-II определяется в коже, кишке, а также почках. При этом сосуды расширяются в мозге, сердце, а также надпочечниках. В мышцах изменение кровотока в этом случае будет незначительным. Если же дозы ангиотензина будут очень большими, в мозге и сердце сосуды могут сузиться. Это вещество в комплексе с ренином образует отдельную систему регуляции.
Ангиотензин может оказывать также косвенное воздействие на эндокринную систему, а также автономную нервную систему. Это вещество стимулирует выработку адреналина, норадреналина, альдостерона. Это усиливает сосудосуживающие воздействия.
Расширить сосуды способны также местные гормоны (серотонин, гистамин, брадикинин и т. д.), а также биологически активные составы.
Приспособление местного кровотока к функциональным потребностям органов осуществляется главным образом путем изменения сопротивления току крови, т.е. путем регуляции гидродинамического сопротивления. Поскольку сопротивление обратно пропорционально радиусу сосудов в четвертой (4) степени, изменение их просвета в значительно большей степени влияет на величину кровотока в органе, чем изменение перфузи онного давления. Просвет сосудов регулируется локальными механизмами, а также нервными и гуморальными факторами.
Местные регуляторные механизмы
.
На степень сокращения гладкой мускулатуры сосудов оказывают прямое влияние некоторые вещества, необходимые для клеточного метаболизма (например, кислород), либо вырабатываемые в процессе метаболизма. В совокупности все они составляют метаболическую ауторегуляцию периферического кровообращения, важнейшее значeние которой состоит в том, что она приспосабливает местный кровоток к функциональной активности органа. При этом преобладают сосудорасширяющие влияния, доминирующие над нервными сосудосуживающими эффектами.
Недостаток кислорода
Pасширение сосудов наступает также при местном напряжении СО и концентрации ионов водорода, а также накопления молочной кислоты, АТФ, АМФ, АДФ и аденозина, повышение концентрации ионов калия и т.д.
Миогенная ауторегуляция
Некоторые сосуды способны поддерживать постоянную объемную скорость кровотока в органе при значительных колебаниях давления. Эту способность можно считать одним из видов миогенной (механогенной) ауторегуляции: она обусловлена реакцией гладких мышц на механическое воздействие (эффект Бейлиса): при растяжении гладкие мышцы сокращаются, причем даже в большей степени, чем это необходимо для сохранения прежней длины. Чем выше давление внутри сосуда, тем сильнее сокращаются гладкие мышцы; в результате при увеличении давления скорость кровотока либо не изменяется, либо возрастает незначительно. Этот механизм стабилизирует кровоснабжение органа. В некоторых органах объемная скорость кровотока не изменяется при колебаниях давления от 120 до 200 мм рт. ст. Классическим примером таких сосудов служат сосуды почек. Миогенная саморегуляция также характерна для сосудов головного мозга, миокарда, печени, кишечника и скелетных мышц. В сосудах кожи она не обнаружена. Миогенная реакция не зависит от вегетативных влияний и поэтому она сохраняется даже после перерезки сосудодвигательных нервов. О механизмах нервной и гуморальной регуляции тонуса сосудов подробнее смотрите материал учебника.
Особенности кровоснабжения отдельных органов у человека
.
Коронарное кровоснабжение.
В покое величина коронарного кровотока у человека равна примерно 0.8-0.9 мл на 1 г ткани миокарда в мин., что для сердца массой 300 г составляет около 250 мл/мин, это приблизительно 4-5 процента от минутного объёма крови. При интенсивной мышечной работе кровоток может возрастать в 4 раза. Коронарный кровоток в отличие от кровообращения в других органах претерпевает значительные колебания, соответствующие периодам работы сердца. Эти колебания обусловлены как пульсирующим характером давления в аорте (от которой отходят коронарные артерии), так и изменениями напряжения в стенке сердца. Под действием этого напряжения сдавливаются сосуды внутренних и средних стенок миокарда, в результате чего во время систолы кровоток в левой коронарной артерии полностью прекращается, тогда как в правом кровоток изменяется в зависимости от давления в аорте. В диастолу объёмная скорость кровотока в бассейне левой и правой коронарных артерий максимальна. Таким образом кровоток, а следовательно, и снабжение миокарда кислородом претерпевают периодические колебания. В систолу оно минимально, а в диастолу максимально. В то же время потребности клеток миокарда в энергии изменяются противоположным образом: они возрастают во время фазы сокращения и снижаются в период расслабления. Существуют 2 механизма, полностью удовлетворяющие в нормальных условиях энергетические потребности миокарда, несмотря на уменьшение доставки кислорода во время систолы. Один из них заключается в том, что миоглобин играет роль кратковременного запаса кислорода. Кислород, запасённый в этом депо поддерживает тканевое дыхание клеток во время систолы. 2-ой механизм сводится к тому, что повышение потребности миокарда в энергии в момент сокращения сердца удовлетворяется за счёт его резервов (АТФ и креатинфосфата). Во время диастолы, благодаря значительному повышению кровотока, миоглобин вновь полностью насыщается кислородом, а клеточные запасы энергии восполняются; в то же время в этот период использование кислорода и энергосубстратов сердцем весьма незначительное. При физической нагрузке создаются дополнительные трудности для нормального снабжения миокарда кислородом. Сердце в этих условиях нуждается в большейдоставке кислорода. В то же время в результате возрастания ЧСС продолжительность диастолы существенно уменьшается. В связи с этим переносимость физической нагрузки ограничена предельной ЧСС, равной приблизительно 200 ударов в минуту. На ЭКГ в этих условиях часто регистрируются типичные изменения, характерные для гипоксии миокарда.
Регуляция коронарного кровотока.
Даже в состоянии покоя сердце извлекает из крови больше кислорода, чем другие органы. Экстракция кислорода сердцем составляет 0,14 мл/л из артериальной крови, содержащей 0,2 мл кислорода в 1 мл (т.е. коэффициент утилизации кислорода в сердце составляет около 70%, тогда как другие органов в покое — 30-40%). В связи с этим увеличение потребности сердца в кислороде при нагрузке не может быть обеспечено за счет увеличения его экстракции. Повышенная потребность миокарда в кислороде удовлетворяется за счет увеличения коронарного кровотока. Это увеличение обусловлено расширением коронарных сосудов, т.е. снижением их гидродинамического сопротивления. Общепризнано, что наиболее мощным стимулом для расширения коронарных сосудов служит недостаток кислорода: дилятация коронарных сосудов наступает уже при снижении со- держания кислорода на 0,01 мл в 1 мл крови. Влияние гипоксии на коронарный кровоток подтверждено в пробе с задержкой дыхания: при этом происходит существенное увеличение кровоснабжения сердечной мышцы. Прямое влияние вегетативных нервов на коронарные сосуды трудно оценить, т.к. эти нервы одновремено влияют на другие параметры деятельности сердца. Pазличные исследователи высказывают противоположные точки зрения по данному вопросу. Подробнее этот вопрос изложен в специальной литературе.
Легочное кровообращение
Легкие снабжаются кровью из обеих кругов кровообращения: малый круг через легочную артерию доставляет венозную кровь в капилляры легочных альвеол для газообмена, а большой круг через бронхиальные артерии доставляет артериальную кровь для питания легочной ткани. В различных отделах сосудистого русла легких артерии и вены значительно короче, а диаметр их, как правило, значительно больше по сравнению с сосудами большого круга кровообращения. Стенки крупных артерий легких относительно тонкие, мелкие же артерии обладают толстыми стенками с развитым мышечным слоем. Диаметр легочных капилляров составляет около 8 мкм, диаметр артериол может достигать 80 мкм (для сравнения: диаметр капилляров и артериол большого круга кровообращения составляет соответственно 3-7 и 15-60 мкм). В связи с этим сопротивление току крови, создаваемое сосудами малого круга кровообращения, примерно в 10 раз меньше, чем в большом круге. Это позволяет правому желудочку работать с меньшей мощностью. У здорового человека давление в легочных сосудах относительно невелико. Систолическое давление в легочной артерии равно 25-30 мм рт. ст., диастолическое — 5-10 мм рт. ст., пульсовое — 15-20, среднее — 13 мм рт.ст. Давление в легочных капиллярах — 6,5 мм рт.ст., в левом предсердии — 55 мм рт.ст. В связи с большей растяжимостью легочных сосудов, объем циркулирующей крови в них может изменяться в сторону уменьшения или увеличения, причем эти колебания могут достигать 200 мл (при среднем содержании в малом круге кровообращения около 440 мл крови). Объем крови в малом круге кровообращения вместе с конечнодиастолическим объемом левого желудочка составляет так называемый центральный объем крови (около 600-650 мл). Этот центральный объем крови представляет собой быстро мобилизуемое депо крови. Так, если необходимо в течении короткого проежутка времени увеличить выброс левого желудочка, то из этого депо может поступить около 300 мл крови. В результате равновесие между выбросом правого и левого желудочков будет поддерживаться до тех пор, пока не включится другой механизм — увеличение венозного возврата.
Регуляция легочного кровообращения.
Легочные сосуды иннервируются симпатическими сосоудосуживающими волокнами. Сосуды легких, как и сосуды большого круга кровообращения, находятся под постоянным тоническим влиянием симпатической нервной системы. При возбуждении барорецепторов каротидного синуса,обусловленного повышением АД, рефлекторно происходит снижение сопротивления сосудов малого круга кровообращения, что приводит к увеличению кровенаполнения легких и нормализации давления в большом круге кровообращения. При возбуждении барорецепторов легочных артерий, расположенных у основания этих артерий в области бифуркации легочного ствола, которое возникает при повышении давления в малом круге кровообращения, рефлекторно снижается давление в большом круге кровообращения за счет замедления работы сердца и расширения сосудов большого круга (рефлекс Парина). Физиологическое значение данного рефлекса состоит в том, что он, разгружая малый круг кровообращения, препятствует перенаполнению легких кровью и развитию их отека. При снижении давления в легочной артерии, напротив, системное давление возрастает, и таким образом, кровенаполнение легких нормализуется.
Местная регуляция легочного кровотока
.
При снижении парциального давления кислорода или повышении парциального давления углекислого газа возникает местное сужение сосудов легких (рефлекс Эймра-Лилиестранда). Благодаря этому механизму, кровоток в отдельных участках легких регулируется в соответствии с вентиляцией этих участков, что позволяет выключить из кровоснабжения невентилируемые альвеолы. Необходимо подчеркнуть, что в случае прекращения вентиляции значительного участка легочной ткани (привоспалении легких), рефлекторно возникает спазм сосудов, питающих пораженный участок. Это может привести к резкому увеличению гидродинамического сопротивления в малом круге кровообращения, и, как следствие, к развитию правожелудочковой недостаточности, особенно у маленьких детей.
Мозговое кровообращение.
Средняя объемная скорость мозгового кровотока составляет примерно 750 мл/мин. т.е. 13% общего сердечного выброса. Кровоснабжение серого вещества примерно в 4 раза больше, чем белого и составляет 0.68-1.1 мл на 1г ткани в минуту. Кровоток может увеличиваться в отдельных областях головного мозга при усилении их активности, однако в целом кровоснабжение мозга при этом изменяется незначительно.
Регуляция мозгового кровотока.
Величина просвета сосудов зависит, в основном, от метаболических факторов, в частности, от напряжения СО в капиллярах и тканях, концентрации ионов водорода в околососудистом пространстве и напряжения кислорода в крови. Увеличение напряжения СО сопровождается выраженным расширением сосудов: так при возрастании напряжения углекислого газа вдвое мозговой кровоток также примерно удваивается. Действие СО опосредованно ионами водорода, выделяющимися при диссоциации угольной кислоты. Другие вещества, при накоплении которых увеличивается концентрация ионов водорода (молочная кислота и другие продукты обмена), также усиливают мозговой кровоток. Неврологические проявления гипервентиляционного синдрома (головокружение, спутанность сознания, судороги и т.д.) обусловлены, напротив, снижением мозгового кровотока в результате гипокапнии. При уменьшении напряжения кислорода сосуды также расширяются, а при повышении суживаются, хотя в целом изменения напряжения кислорода в крови оказывают меньшее влияние на кровоток, чем сдвиги напряжения углекислого газа. В сосудах мозга хорошо выражена миогенная ауторегуляция, поэтому при изменениях гидростатического давления в связи с переменой положения головы мозговой кровоток остается постоянным. Таким образом, кровоснабжение головного мозга регулируется преимущественно местными метаболическими и миогенными механизмами. Влияние вегетативных нервов на мозговые сосуды имеет второстепенное значение.
Почечное кровообращение.
Средняя объемная скорость почечного кровотока в покое составляет около 4,0 мл на 1 г ткани в минуту, т.е. в целом для почек, масса которых 300 г, примерно 1200 мл/мин, что составляет около 20% сердечного выброса. Особенность кровоснабжения почек заключается в наличии двух последовательных капиллярных сетей. Приносящие (афферентные) артериолы распадаются на клубочковые капилляры, отделенные от канальцевого капиллярного ложа выносящими (эфферентными) артериолами. Эфферентные артериолы характеризуются высоким гидродинамическим сопротивлением. Давление в клубочковых капиллярах довльно велико (порядка 60-70 мл рт.ст.), а в околоканальцевых относительно мало (около 13 мм рт.ст.).
Регуляция почечного кровообращения.
Для сосудов почек хорошо развиты миогенные ауторегуляторные механизмы, благодаря которым кровоток и капиллярное давление в области нефронов поддерживается на постоянном уровне при колебаниях артериального давления от 80-120 до 180-200 мм рт.ст. Почечные сосуды иннервируются соматическими сосудосуживающими нервами.Тонус этих нервов в покое невелик.При переходе человека в вертикальное положение, почечные сосуды участвуют в общей вазоконстрикторной реакции, обеспечивающей поддержание кровоснабжения головного мозга и сердца. Почечный кровоток снижается также при физической нагрузке и в условиях высокой температуры окружающей среды. Это обеспечивает компенсацию снижения АД, связанного с расширением мышечных и кожных сосудов. Характерной особенностью сосудов почек является их низкая способность к расширению, в связи с чем затруднено увеличение почечного кровотока путем снижения гидродинамического сопротивления. Поэтому в случае снижения кровоснабжения почек запускаются механизмы, направленные на увеличение перфузи онного давления,в частности, усиливается выработка ренина. Активация ренин-ангиотензинной системы, приводящая к подъемусистемного давления, в какой-то мере увеличивает и почечный кровоток.
Кровоснабжение в скелетных мышцах.
Кровоток в скелетных мышцах в покое составляет около 0.03-0.04 мл на 1 г ткани в минуту. Поскольку общая масса мышц примерно равна 30 кг,то в целом мышечный кровотоксоставляет приблизительно 900-1200 мл/мин, т.е.15-20% общего сердечного выброса. При максимальной физической нагрузке мышечный кровоток может достигать 20-22 л/мин при сердечном выбросе, равном 25 л, т.е. 80-90% общего кровотока. У тренированных спортсменов эта величина может быть даже больше.
Регуляция мышечного кровотока
.
Сосуды скелетных мышц иннервируются симпатическими сосудосуживающими и сосудорасширяющими волокнами.В окончании симпатических вазоконстрикторов выделяется норадреналин, в окончаниях вазодилятаторов-ацетилхолин, поэтому симпатические сосудорасширяющие волокна в скелетных мышцах относят к холинэргическим волокнам. Роль вазодилятаторных нервов может быть проиллюстрирована тем фактом, что у человека, готовящегося к мышечной деятельности, повышение симпатического тонуса может привести к четырёхкратному увеличению кровотока в мышцах. При мышечной работе местные метаболические регуляторные влияния на сосуды значительно преобладают над нервными. Вместе с тем на величину кровотока влияет также механическое сдавление сосудов соприкасающимися мышцами. При сокращении мышцы кровоток вначале снижается, затем возрастает даже по сравнению с исходным состоянием. В фазе расслабления он ещё больше увеличивается;это так называемая реактивная гиперемия, обусловленная сосудорасширяющим действием продуктов метаболизма. Ритмические мышечные сокращения сопровождаются колебаниями кровотока -уменьшением его во время сокращения и повышением — в фазе расслабления. При этом средняя скорость кровотока всегда больше, чем в покое. Т.о., при динамической мышечной работе, когда сокращения и расслабления постоянно чередуются, мышцы утомляются меньше, чем при статической нагрузке.
Кожное кровообращение.
Даже в условиях нейтральной температуры окружающей среды ( около 20 С для легко одетого человека) кровоток в различных участках кожи в покое значительно колеблется.Кожный кровоток изменяется в пределах от 0,03 до 0,0n мл на 1кг ткани в минуту,или в целом, учитывая вес кожных покровов5 кг — от 160 до 500 мл/мин или 3-10% от величины сердечного выброса.
Регуляция кожного кровотока.
В регуляции кожного кровотока участвуют два различных механизма, роль которых в различных участках кожи различна.Сосуды кожи акральных участков (кисти рук,стопы,мочки ушей) богато иннервированные симпатическими адренергическими соудосуживающими волокнами,обладающими относительно высоким тонусом в покое и при нейтральной температуре.Расширение этих сосудов связано с центральным торможением тонуса сосудосуживающих нервов.Расширение же сосудов кожи проксимальных участков конечностей и туловища происходит преимущественно непрямым путем:оно опосредовано выделением брадикинина при возбуждении холинергических потоотделительных волокон. Сужение всех кожных сосудов обусловлено повышением тонуса симпатических адренергических волокон. Благодаря большой мощностиподсосочкового венозного сплетения (около 1500 мл ) изменение тонуса кожных вен может сопровождаться значительными сдвигами объема крови в сосудах кожи.Таким образом,важная функция кожных сосудов заключается в депонировании крови.
Кожный кровоток и терморегуляция.
Важнейшей функцией кровотока кожи является участие в механизмах терморегуляции.При тепловом стрессе величина общего кровотока в коже может возрасти до 3 л/мин.Однако,в разных участках кожи эти изменения значительно варьируют.Наибольшие колебания кровотока наблюдаются в коже дистальных отделов конечностей.Так,если палец руки из холодной воды поместить в горячую,то кровоток в нем может увеличиться с 0,01 до 1 мл/мин на 1г ткани,т.е. в 100 раз и более.Реакция сосудов кожи проксимальных участков конечностей туловища на аналогичное воздействие значительно слабее. Увеличение кожного кровотока в условиях высокой внешней температуры связано с открытием множества артерио-венозных анастомозов,по которым часть крови оттекает в вены,минуя капилляры.Благодаря высокой теплопроводности кожи этот механизм служит чрезвычайно эффек- тивным способом отдачи тепла через кожу.
Возрастные реакции
Различают возрастные особенности регуляции кровообращения. В детском и взрослом возрасте они значительно отличаются. Также на этот процесс влияет тренированность человека. У новорожденных ярко выражены симпатические и парасимпатические нервные окончания. До трех лет у детей преобладает тоническое влияние нервов на сердце. Центр блуждающего нерва отличается в этом возрасте низким тонусом. Он начинает влиять на кровообращение еще в 3-4 месяца. Однако ярче этот процесс проявляется в более взрослом возрасте. Это становится заметно в школьном возрасте. В этот период частота сердечных сокращений у ребенка снижается.
Рассмотрев особенности регуляции кровообращения, можно сделать вывод о сложности этого процесса. Множество факторов, механизмов влияет на него. Это позволяет четко реагировать на любые изменения окружающей среды, регулировать поступление жизненно важных веществ к органам, которые в данный момент больше загружены.