Общее описание
Артериовенозная мальформация — это состояние, при котором между артериями и венами вместо сети капилляров появляются патологически извитые шунтирующие сосуды. Может возникнуть в любом месте, но клинически наиболее значима артериовенозная мальформация головного мозга. В результате замещения капиллярного русла нарушается обмен кислородом и питательными веществами между тканями и кровью, мозг испытывает кислородное голодание. Кроме того, сосуды при артериовенозной мальформации головного мозга имеют более тонкую стенку, чем в норме, поэтому могут разорваться. Риск разрыва достигает 4% в год. Летальность при разрыве АВМ у неоперированных больных достигает 30%, инвалидизация – 50%.
Методы диагностики
В случае тяжелых аномалий диагностика может производится при визуальном осмотре. Показаниями для дополнительного обследования могут стать:
- Гипотония мышц в неонатальный период;
- Появление судорожного синдрома;
- Задержка психического развития.
Способами диагностики являются:
- Скрининговое и акушерское УЗИ во время беременности;
- Нейросонография через родничок в первые 1-1,5 года жизни;
- ЭЭГ и ЭЭГ-видеомониторинг позволяют установить наличие судорожного синдрома и подобрать эффективную антиконвульсивную терапию;
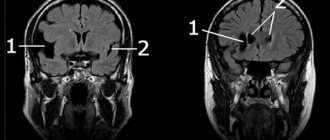
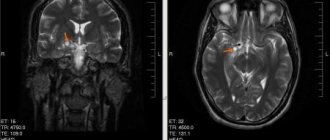
- Магнитно-резонансная томография, являющаяся наиболее информативным методом, позволяющим визуализировать патологии, их структуру, форму, размер и локализацию.
Для обнаружения сопутствующих соматических пороков показано проведение УЗИ почек, сердца, брюшной полости. Кроме того может потребоваться консультация генетика.
Церебральные аномалии необходимо отличать от асфиксии или гипоксии плода, травм новорожденных.
Симптомы
Артериовенозная мальформация может протекать бессимптомно, в таком случае пациент так и не узнает, что имел эту патологию. В половине диагностированных случаев заболевание манифестировало с кровотечения. Разрыв деформированного сосуда грозит геморрагическим инсультом, инвалидизацией и смертью. Еще в четверти случаев мальформация вызывает эпилептические припадки. Крупные и растянутые сосуды могут быть причиной затяжных и некупируемых головных болей, а если размер их настолько большой, что приводит к сдавлению ткани мозга, то может возникнуть очаговый неврологический дефицит.
Причины появления нарушений
Моногенное наследование становится причиной возникновения аномалии лишь в 1% случаев. Чаще всего сбои внутриутробного развития вызывает влияние на организм матери и ребенка ряд вредных факторов тератогенного действия. К экзогенным факторам относятся:
- Радиоактивное облучение;
- Воздействие химических веществ;
- Высокая температура;
- Действие высокочастотных токов;
- Неблагополучная экологическая обстановку, обуславливающая попадание в организм беременной токсических веществ.
Кроме того тератогенными могут являться многие лекарственные и гормональные препараты, которые принимает мать на ранних сроках, не подозревая о беременности. Доказано, что большинство фармакологических препаратов легко преодолевают плацентарный барьер, попадая в кровеносную систему ребенка. Опасным может оказаться даже прием больших доз препаратов кальция и витаминных комплексов. Неблагоприятной для формирования здорового плода является иммунная несовместимость матери и ребенка. Также спровоцировать пороки развития могут дисметаболические нарушения, вирусные и внутриутробные инфекции, в том числе и протекающие бессимптомно. Очень опасны:
- Гипертиреоз;
- Сахарный диабет;
- Патологии обмена веществ;
- Сифилис;
- Цитомегалия;
- Краснуха;
- Листериоз;
- Токсоплазмоз.
Огромное влияние на благополучное течение беременности оказывает образ жизни беременной. Тератогенное воздействие оказывают:
- Наркомания;
- Алкоголизм;
- Курение.
Лечение АВМ головного мозга
Лечение заключается в хирургическом удалении патологических сосудов. Классическое открытое иссечение мальформации применяется в основном только в экстренном случае, при разрыве сосуда, когда нужно не только удалить его, но и аспирировать образовавшуюся гематому.
При неосложненной мальформации можно прибегнуть к ангиоэмболизаии, когда в патологиечский сосуд вводится эмболизирующее вещество, просвет его навсегда закрывается и сосуд функционально исчезает.
Наиболее современный способ — радиохирургическое вмешательство, в ходе которого происходит облучение мальформации, приводящее к полному закрытию просвета сосуда.
Сосудистые когнитивные расстройства
О статье
4396
0
Регулярные выпуски «РМЖ» №12 от 24.06.2005 стр. 789
Рубрика: Общие статьи
Авторы: Яхно Н.Н. 1 , Захаров В.В. 1 НИО неврологии НИЦ ФГАОУ ВО «Первый МГМУ им. И. М. Сеченова» МЗ РФ
Для цитирования:
Яхно Н.Н., Захаров В.В. Сосудистые когнитивные расстройства. РМЖ. 2005;12:789.
Цереброваскулярные расстройства представляют собой одно из наиболее распространенных патологических состояний в неврологической практике. Недостаточность мозгового кровообращения закономерно возникает при атеросклерозе магистральных артерий головы, гипертонической болезни, других заболеваниях сердечно–сосудистой системы. Важно отметить, что в последние годы отмечается тенденция к увеличению встречаемости сердечно–сосудистых нарушений не только в пожилом возрасте, но и среди лиц среднего и молодого возраста. Патология церебральных сосудов может приводить как к повторным острым нарушениям мозгового кровообращения, так и к хронической ишемии мозга. Часто всего повторные инсульты и хроническая ишемия сосуществуют, и оба эти патогенетических фактора со временем приводят к формированию клинического синдрома дисциркуляторной энцефалопатии (ДЭ) [2].
Практикующему неврологу хорошо известны клинические проявления ДЭ. Важное место среди них занимают нарушения когнитивных функций. Когнитивные расстройства являются, вероятно, самым частым проялением сосудистой мозговой недостаточности. При этом выраженность когнитивных нарушений может значительно варьировать в зависимости от стадии процесса и тяжести основного сосудистого заболевания. Традиционно основным объектом интереса врачей и исследователей была сосудистая деменция, которая, как считается, является второй по распространенности в популяции после первично–дегенеративной. Однако в настоящее время все больше внимания уделяется менее тяжелым когнитивным нарушениям. Это отражает общую тенденцию в современной нейрогериатрии к максимальной оптимизации ранней диагностики и терапии когнитивной недостаточности. В 1994 году один из наиболее авторитетных мировых ангионеврологов В. Хачински предложил использовать термин «сосудистые когнитивные расстройства» (англ. vascular cognitive impairment, VCI) для обозначения нарушений высших мозговых функций вследствие цереброваскулярной патологии [34]. Это понятие объединяет как сосудистую деменцию, так и менее тяжелые нарушения когнитивных функций сосудистой этиологии. Сосудистые когнитивные расстройства (СКР) имеют характерные особенности патогенеза и клиники, а также течения, которые позволяют дифференцировать данный вид нарушений когнитивных функций от также весьма распространенных когнитивных нарушений нейродегенеративной природы. Механизмы возникновения сосудистых когнитивных расстройств Когнитивные нарушения при сосудистой мозговой недостаточности развиваются в результате повторных инсультов, хронической ишемии мозга или сочетания обоих названных патогенетических факторов. Принято разделять СКР на два основных варианта: СКР при патологии крупных сосудов и СКР при патологии мелких сосудов. Патология крупных церебральных артерий (атеросклероз, кардиогенная тромбоэмболия), как известно, приводит к крупноочаговым инфарктам мозга корковой локализации. Поскольку когнитивные функции обеспечиваются интегративной деятельностью всего головного мозга, когнитивные нарушения могут возникать при различной локализации ишемического очага. При этом характер когнитивных расстройств напрямую будет зависеть от локализации инфаркта мозга, а выраженность – от его размера. Таким образом, когнитивные нарушения при патологии крупных церебральных артерий представляют собой весьма разнородную по характеру и выраженности группу нейропсихологических синдромов [35]. Более однородными по клинической картине являются СКР, связанные с патологией сосудов небольшого калибра. Как известно, самой частой причиной поражения малых сосудов является гипертоническая болезнь. Анатомические особенности кровоснабжения головного мозга таковы, что при неконтролируемой артериальной гипертензии в первую очередь страдают глубинные отделы белого вещества головного мозга и подкорковые базальные ядра. Указанные отделы головного мозга являются «излюбленным» местом локализации лакунарных инфарктов. Отражением хронической ишемии мозга являются изменения белого вещества (так называемый лейкоареоз), которые также отмечаются прежде всего в глубинных церебральных отделах [6]. Базальные ганглии являются очень важными для когнитивной деятельности интегративными образованиями, через которые связываются между собой ассоциативные зоны передних и задних отделов коры головного мозга [47]. Поражение белого вещества также вызывает когнитивную дисфункцию, так как ведет к деафферентации лобных долей головного мозга (так называемый, «феномен разобщения»). Таким образом, преимущественным результатом поражения глубинных отделов белого и серого вещества является вторичная дисфункция передних отделов головного мозга. Предполагается, что дисфункция лобных долей головного мозга играет ключевую роль в формировании когнитивных расстройств при патологии сосудов небольшого калибра [2,3,6,22,36]. Клинические особенности сосудистых когнитивных расстройств Как уже было отмечено, клиническая картина СКР при патологии крупных сосудов весьма гетерогенна и определяется главным образом локализацией перенесенных инсультов. В отличие от этого СКР при артериальной гипертензии достаточно единообразны в силу указанных выше анатомических особенностей кровоснабжения головного мозга. Типическими проявлениями СКР при патологии сосудов небольшого калибра являются нейропсихологические симптомы лобной дисфункции. Согласно теории системной динамической локализации высших мозговых функций А.Р. Лурия, функция лобных долей головного мозга заключается в программировании произвольной деятельности и в контроле за выполнением намеченной программы [7]. Одним из первых симптомов лобной дисфункции при СКР часто является замедленность мышления: пациентам требуется больше времени и усилий для выполнения различных умственных упражнений, им становится трудно сосредоточиться. Характерны нарушения произвольного внимания: больные испытывают трудности переключения с одного этапа деятельности на другой, либо, напротив, отвлекаются от намеченной программы. Следствием указанных нарушений являются персеверации и повышенная импульсивность. Характерно также нарушение аналитических способностей. Так, например, пациенты с СКР будут испытывать трудности при обобщении понятий или при попытках объяснить значение пословиц и поговорок [1–3,12,15,22]. Базальные ганглии являются важным сенсорным реле и участвуют в формировании пространственных представлений [10,48]. Поражение указанных анатомических образований может приводить к возникновению зрительно–пространственных нарушений. Простейшим тестом для диагностики данного вида расстройств является тест рисования часов: больного просят самостоятельно нарисовать круглые часы с цифрами на циферблате и поставить стрелки на определенное, указанное врачом время. Нарушения памяти на текущие события не характерны для СКР. Наличие таких нарушений почти всегда указывает на присутствие сопутствующего нейродегенеративного процесса. Однако при СКР могут развиваться нарушения оперативной памяти. При этом пациентам сложно удерживать большие объемы информации и быстро переключаться с одного источника информации на другой. Нарушения оперативной памяти существенно затрудняют процессы обучения и получения новых навыков, но, как уже указывалось выше, не распространяются на запоминание и воспроизведение событий жизни [13]. Когнитивные нарушения при СКР почти всегда сочетаются с эмоциональными и поведенческими расстройствами, так как в основе последних также лежит вторичная дисфункция лобных долей головного мозга. Хорошо известно, что легкая депрессия часто отмечается уже на самых ранних стадиях сосудистой мозговой недостаточности. Именно данный вид эмоциональных нарушений лежит в основе неспецифических жалоб на головную боль, тяжесть в голове, несистемное головокружение, повышенную утомляемость, которые регулярно встречаются на I стадии дисциркуляторной энцефалопатии. Более выраженные нарушения могут сопровождаться эмоциональной лабильностью, уменьшением мотивации и инициативы, снижением критики, неадекватностью поведения [2,11]. Когнитивные нарушения при сосудистой мозговой недостаточности весьма варьируют по выраженности. Наиболее тяжелые нарушения, которые вызывают профессиональную и бытовую дезадаптацию пациента, принято обозначать термином сосудистая деменция. Менее тяжелые нарушения, которые, тем не менее, выходят за рамки возрастной нормы и заметны для окружающих, согласно современным представлением называют умеренными когнитивными нарушениями (УКН). Для диагностики УКН в настоящее время используются критерии, разработанные лабораторией памяти Клиники Мэйо (табл. 1) [46]. В исследовании, проведенном в нашей клинике, было показано, что среди пациентов с синдромом ДЭ I и II стадии когнитивные нарушения соответствовали принятым диагностическим критериям УКН в 56% случаев. Остальные пациенты, по нашим данным, также не были безупречны в когнитивном отношении. Еще у 32% при детальном нейропсихологическом исследовании выявлялись небольшие трудности выполнения отдельных тестов, в основном в результате замедленности и нарушения концентрации внимания. Указанные когнитивные симптомы не были заметны для окружающих, но часто вызывали субъективное беспокойство. Таким образом, по нашему мнению, наряду с синдромом умеренных когнитивных нарушений целесообразно выделять синдром легких когнитивных нарушений (ЛКН). При ЛКН нарушения незаметны для окружающих, но ощущаются самим пациентом и подтверждаются при тщательном исследовании с применением чувствительных методик [16]. Взаимосвязь СКР и нейродегенеративного процесса Согласно эпидемиологическим данным цереброваскулярные расстройства являются второй по частоте причиной когнитивной недостаточности в пожилом возрасте, уступая лидерство болезни Альцгеймера (БА). Однако в последнее время все большее число исследований свидетельствуют о значительной распространенности смешанных форм, когда у одного и того же пациента определяются признаки как дегенеративного, так и сосудистого поражения головного мозга. Так, по данным американских клинико–морфологических сопоставлений у 48% пациентов с БА при аутопсии выявляются лакунарные инфаркты и лейкоареоз. С другой стороны, у 77% пациентов с клиническим диагнозом сосудистая деменция при морфологическом исследовании определяются признаки дегенеративного процесса в виде сенильных бляшек и нейрофибриллярных сплетений [20,30,39,43]. Широко обсуждаются причины столь частого сосуществования самых распространенных этиологических форм когнитивных нарушений. Одна из причин достаточно очевидна: как БА, так и цереброваскулярные расстройства являются заболеваниями пожилого возраста. Одновременное наличие у пожилого человека нескольких хронических заболеваний, конечно же, не является чем–то исключительным. Однако, фактическая распространенность смешанных сосудисто–дегенеративных когнитивных расстройств значительно превосходит ожидаемую распространенность при случайном совпадении двух заболеваний. В ряде работ было показано, что гипоксия вследствие хронической ишемии мозга увеличивает риск реализации генетической предрасположенности к БА и ускоряет темп прогрессирования нейродегенеративного процесса. При этом особенно чувствительны к ишемии и гипоксии структуры гиппокампового круга, в которых при БА выявляются наиболее выраженные патоморфологические изменения. С другой стороны, ключевым событием патогенеза БА является образование патологического белка – b–амилоида, который откладывается как в паренхиме головного мозга, так и в церебральных сосудах [3,8,9,41]. Наличие сопутствующих цереброваскулярных расстройств оказывает существенное влияние на клинические проявления БА. Так, в работе Э.О. Мхитарян было показано, что у пожилых пациентов с БА и значимой сосудистой мозговой недостаточностью уже при легкой выраженности деменции выявляются нейропсихологические симптомы лобной дисфункции. Известно, что при «чистой» БА передние отделы лобных долей вовлекаются в патологический процесс лишь на поздних стадиях заболевания [8]. С другой стороны, по нашим данным, у части пациентов с ДЭ I и II степени и синдромом УКН выявляются нейропсихологические признаки начальных стадий БА. Так, у 23% из 56% наблюдавшихся нами пациентов с ДЭ и УКН, наряду с типичными клиническими проявлениями СКР, определялись первичные нарушения памяти и номинативной функции речи, характерные для нейродегенеративного процесса. В этих случаях, по нашему мнению, весьма вероятна смешанная, сосудисто–дегенеративная природа когнитивных нарушений. У остальных пациентов с ДЭ и УКН когнитивные нарушения характеризовались главным образом нейропсихологическими симптомами лобной дисфункции, что может говорить об их преимущественно сосудистой этиологии [16]. Таким образом, выявление клинических особенностей когнитивных нарушений имеет важное значение для определения этиологии нарушений. Недостаточность запоминания текущих событий, нарушение номинативной функции речи отражают заинтересованность гиппокампа и левой височной доли, что характерно для нейродегенеративного процесса в рамках БА. Нейропсихологические симптомы лобной дисфункции при легкой и умеренной выраженности когнитивной недостаточности более характерны для СКР. В клинической практике нередко отмечается сочетание первичных нарушений памяти и лобной дисфункции. В таких случаях закономерно предполагать сосуществование БА и СКР. При этом легкая и умеренная выраженность когнитивных расстройств, медленное прогрессирование или относительно стационарное состояние когнитивных нарушений не должны рассматриваться как признаки, исключающие БА. Известно, что при начале этого заболевания в пожилом возрасте (после 65–70 лет), оно нередко носит относительно доброкачественный характер [3,41]. Диагностика СКР Для объективизации когнитивных нарушений применяют нейропсихологические методы исследования. Общепринятым стандартом скрининга когнитивных нарушений является краткая шкала оценки психического статуса (КШОПС) [28]. Однако следует иметь в виду, что данная методика была изначально разработана для диагностики БА. Задания, включенные в данную шкалу, оценивают память, ориентировку, счет, речь и конструктивный праксис, то есть те когнитивные функции, которые наиболее уязвимы при БА. Пациенты с СКР, даже при значительной выраженности нарушений, могут получить по КШОПС достаточно высокий балл. Поэтому при подозрении на сосудистую этиологию когнитивных расстройств целесообразно дополнять КШОПС нейропсихологическими тестами, чувствительными в отношении лобной дисфункции. Короткая батарея наиболее простых лобных тестов с формализованной количественной оценкой результатов была предложена в 1999 году французским неврологом Б. Дюбуа и несколько лет успешно применяется в нашей клинике (табл. 2) [24]. Помимо верификации когнитивных нарушений, для обоснованного диагноза СКР необходимо выявление основного сосудистого заболевания. Для этого целесообразно полноценное клинико–инструментальное обследование с применением методов нейровизуализации: компьютерной либо (предпочтительно) магнитно–резонансной томографии головного мозга. Однако важно подчеркнуть, что само по себе установление наличия когнитивных нарушений и сосудистой мозговой недостаточности не означает причинно–следственной связи между первым и вторым. Аргументами в пользу такой связи, согласно мнению большинства исследователей, могут быть либо временные взаимоотношения (возникновение когнитивных нарушений в первые месяцы после инсульта) либо характерные клинические особенности когнитивных нарушений в виде преобладания симптомов лобной дисфункции. Лечение сосудистых когнитивных расстройств Терапевтические мероприятия при СКР должны быть направлены на основное сосудистое заболевание, а также на улучшение микроциркуляции и церебрального метаболизма. На стадии сосудистой деменции целесообразна также симптоматическая заместительная нейротрансмиттерная терапия. Лечение основного заболевания. Поражение головного мозга, приводящее к формированию СКР, всегда является осложнением заболеваний сердечно–сосудистой системы. Поэтому при наличии СКР обязательной является тщательная оценка состояния сердечно–сосудистой системы. По соответствующим показаниям должны применяться антигипертензивные препараты, антиагреганты и гиполипидемические средства. Важное значение имеет контроль сердечного ритма, сахарного диабета, отказ от курения, борьба с избыточным весом и гиподинамией, устранение других корригируемых факторов риска церебральной ишемии. В случае гемодинамически значимого стеноза церебральных артерий могут обсуждаться методы сосудистой хирургии. Вазоактивные препараты. Необходимой составной частью патогенетической терапии СКР является улучшение церебральной микроциркуляции. С этой целью широко применяются ингибиторы фосфодиэстеразы (пентоксифиллин, винпоцетин), блокаторы кальциевых каналов (циннаризин, флюнаризин), a–адреноблокаторы (ницерголин) и некоторые другие препараты. Весьма выгодным профилем фармакологической активности обладает препарат Танакан, высокоэффективный церебропротектор широкого спектра действия, состоящий из натуральных компонентов. Танакан оказывает разностороннее положительное воздействие на мозговой кровоток, не вызывая эффекта «обкрадывания». Этот эффект достигается за счет нормализации тонуса сосудов пораженной области, а не простого их повсеместного расширения. За счет ингибирования фактора активации тромбоцитов Танакан снижает степень агрегации форменных элементов крови, улучшая тем самым ее реологические свойства [19,33]. Одним из наиболее важных качеств Танакана является способность компонентов данного препарата дезактивировать свободные радикалы. Антиоксидантные свойства Танакана были продемонстрированы в многочисленных экспериментальных работах [23,31,32,38,45]. Поскольку процессы перекисного окисления липидов играют весьма существенную роль в повреждении нейронов как при гипоксии, так и при нейродегенеративных процессах, наличие у Танакана антиоксидантных свойств позволяет использовать данный препарат при «чистых» СКР и при когнитивных нарушениях смешанной, сосудисто–дегенеративной природы. Клиническая эффективность Танакана была доказана в большой серии двойных слепых плацебо–контролируемых исследований. Препарат оказывает положительный ноотропный эффект в виде улучшения памяти, внимания и других когнитивных функций, способствует нормализации биоэлектрической активности головного мозга как у пациентов с сосудистой мозговой недостаточностью, так и при нейродегенеративном процессе [5,29,37,40,42]. Есть наблюдения, что длительный прием Танакана уменьшает риск возникновения болезни Альцгеймера, а у пациентов с этим заболеванием – способствует уменьшению темпов прогрессирования когнитивных расстройств [17,21]. Важным преимуществом Танакана является его хорошая переносимость. Он крайне редко оказывает какие–либо побочные эффекты. Препарат не влияет на системную гемодинамику и жизненно важные функции, не оказывает лекарственного взаимодействия с какими либо другими препаратами. Препарат применяется в дозах 40–80 мг два–три раза в сутки. Метаболические препараты. Метаболические препараты способствуют увеличению нейрональной пластичности, то есть свойства нейронов менять свои функциональные свойства в зависимости от условий среды. Нейрометаболическая терапия имеет особенное значение в восстановительном периоде ишемического инсульта, черепно–мозговой травмы или иного острого поражения ЦНС. Широкий практический опыт свидетельствует о целесообразности применения метаболических препаратов при когнитивных нарушениях, особенно легкой и умеренной выраженности [3]. К препаратам с метаболическим действием относятся пирацетам и его производные. Метаболическим эффектом обладают биологически активные аминокислоты и полипетиды, которые содержатся в таких препаратах, как церебролизин и др. Наряду со всеми изложенными выше свойствами Танакан также оказывает положительный нейрометаболический эффект. Подобная широта фармакологического действия позволяет применять Танакан в виде монотерапии у молодых пациентов при начальных формах ДЭ и связанных с ними когнитивных нарушениях и у пациентов старческого возраста при полиорганной патологии с целью уменьшения лекарственной нагрузки и минимизации побочных эффектов проводимой терапии. Заместительная нейротрансмиттерная терапия. На стадии сосудистой деменции патогенетически оправдано применение ацетилхолинергических и глутаматергических препаратов. В настоящее время имеются клинические доказательства эффективности ингибиторов ацетилхолинэстеразы (галантамин, ривастигмин) и блокатора NMDA–рецептора мемантина при сосудистой и смешанной деменции [18,25–27,44]. Обсуждается использование данных препаратов на этапе умеренных когнитивных нарушений, однако этот вопрос требует дальнейшего изучения. На этапе легких когнитивных нарушений с симптоматической целью можно применять дофаминергический препарат пирибедил, что, по некоторым данным, способствует уменьшению выраженности характерных для СКР нейропсихологических симптомов лобной дисфункции [4]. Заключение Таким образом, СКР являются весьма распространенной в практике неврологической патологией. При этом о сосудистой этиологии когнитивных нарушений будут свидетельствовать нейропсихологические особенности выявляемых расстройств, отражающие их связь с дисфункцией лобных отделов головного мозга. Наличие наряду с нейропсихологическими симптомами лобной дисфункции первичных нарушений памяти свидетельствует в пользу смешанной сосудисто–дегенеративной этиологии когнитивных расстройств. Терапия СКР, направленная как на лечение основного заболевания, так и на нейрохимические механизмы когнитивных нарушений, способствует улучшению качества жизни пациента и его родственников при любой выраженности нарушений. Однако наибольшего эффекта терапии следует ожидать при ее начале на этапе легкой деменции или когнитивных нарушений не достигающих стадии деменции. Литература 1. Дамулин И.В., Яхно Н.Н. Сосудистая мозговая недостаточность у пациентов пожилого и старческого возраста (клинико–компьютерно–томографическое исследование). //Ж Невропатологии и Психиатрии. –1993. –Т.93. –N.2. –С.10–13. 2. Дамулин И.В. Дисциркуляторная энцефалопатия в пожилом и старческом возрасте. //Автореф. диссЕ докт. мед. наук. –М. –1997. –32 с. 3. Дамулин И.В. Болезнь Альцгеймера и сосудистая деменция. //Под ред. Н.Н.Яхно. –М., 2002. –85 с. 4. Захаров В.В., Локшина А.Б. Применение препарата проноран (пирибедил) при легких когнитивных расстройствах у пожилых больных с дисциркуляторной энцефалопатией. //Неврологический журнал. –2004. 5. Захаров В.В. Применение танакана в нейрогериатрической практике. // Неврологический журнал. –1997. –Т.5. –С.42–49. 6. Левин О.С., Дамулин И.В. Диффузные изменения белого вещества (лейкоареоз) и проблема сосудистой деменции. 7. Лурия А.Р. Высшие корковые функции человека. /М.: изд–во МГУ. –1969 г. 8. Мхитарян 9. Преображенская И.С., Мхитарян Э.А., Яхно Н.Н. Роль сосудистых нарушений в патогенезе дегенеративной деменции. //Фундаментальные науки и прогресс клинической медицины. Научно–практическая конференция. –2002. –Тезисы докладов. –С.321. 10. Толкунов Б.Ф. Стриатум и сенсорная специализация нейронной сети. //Ленинград: изд–во «Наука». –1978. –С.178. 11. Янакаева Т.А. Сравнительный анализ когнитивных и аффективных расстройств при дисциркуляторной энцефалопатиии и болезни Паркиснона. //Дисс… канд. мед. наук. –Москва. –1999. 12. Яхно Н.Н., Дамулин И.В., Бибиков Л.Г. Хроническая сосудистая мозговая недостаточность у пожилых: Клинико–компьютерно–томографические сопоставления. //Клиническая геронтология. –1995. –N.1. –С.32–36. 13. Яхно Н.Н., Захаров В.В. Нарушения памяти в неврологической практике. //Невролог. журн. –1997. –№.4. –С.4–9. 14. Яхно Н.Н., И.В.Дамулин, В.В.Захаров и соавт. Применение танакана при начальных стадиях сосудистой мозговой недостаточности: результаты открытого мультицентрового исследования. //Неврологический журнал. –1998. –Т.3. –С.18–22. 15. Яхно Н.Н., Левин О.С., Дамулин И.В. Сопоставление клинических и МРТ–данных при дисциркуляторной энцефалопатии. Сообщение 2: когнитивные нарушения. //Неврол.журн. –2001. –Т.6, № 3. –С.10–19. 16. Яхно Н.Н., Захаров В.В., Локшина А.Б. Синдром умеренных когнитивных нарушений при дисциркуляторной энцефалопатии. // Ж Неврол Психиатр. –2005. –Т.105. –№2. –С.13–17. 17. Andrieu S., Amouyal K., Reinish W., Nourhashemi F., Vellas B., Albarede J.L., Granjean H. for EPIDOS group. The consumption of vasodilators and Gingko biloba (Egb 761) in a population of 7598 women over the age of 75 years. // Research and practice in Alzheimer’s disease. –2001. –V.5. –P.57–68. 18. Areosa S.A., Sheriff F. Memantine for dementia (Cochrane Review). //The Cochrane Library. –Issue 1. Chichester: John Willey a Sons Ltd. –1004. 19. Auguet M., F.V.DeFeudis, F.Clostre. Effects of Ginkgo biloba on arterial smooth muscle responses to vasoactive stimuli. //Gen Pharmacol. –1982. –V.13. –P.169–171. 20. Barker W.W., Luis C.A., Kashuba A. et al. Relative frequencies of Alzheimer disease, Lewy body, vascular and frontotemporal dementia, and hippocampal sclerosis in the State of Florida Brain Bank. //Alzheimer Dis Assoc Disord. –2002. –V.16. –P.203–212. 21. Bars P., Katz M., Berman N., Itil T., Freedman A., Schatzberg A. A placebo–controlled, double–blind, randomized trial of an extract of ginkgo biloba for dementia. // JAMA. – 1997. –Vol.278, N.16. –P.1327–1332. 22. Cummings J.L. Vascular subcortical dementias: clinical aspects. //In: Vascular dementia. Ethiological, pathogenetic, clinical and treatment aspects. Ed. By L.A.Carlson, C.G.Gottfries, B.Winblad. –Basel etc.: S.Karger. –1994. –P.49–52. 23. Deby C., G.Deby–Dupont, M.Dister, J.Pincmail. Efficiency of Ginkgo biloba extract (EGb 761) in neutralizing ferrylion–induced peroxidations: therapeutic implications. //In: C.Ferradini, M.T.Droy–Lefaix, Y.Christen (eds): Ginkgo biloba extract as free radical scavenger. Advances in Ginkgo biloba Extract Research; –1993. –V.2.–P.13–26. 24. Dubois B., A.Slachevsky, I.Litvan, B.Pillon. The FAB: a frontal assessement battery at bedside. //Neurology. –2000. –V.55. –P.1621–1626. 25. Erkinjuntti T., Roman G., Gauthier S. et al. Emerging therapies for vascular dementia and vascular cognitive impairment. //Stroke. –2004. –Vol.35. P.1010–1017. 26. Erkinjuntti T., Roman G., Gauthier S. Treatment of vascular dementia–evidence from clinical trials with cholinesterase inhibitors. //J Neurol Sci. –2004. –Vol.226. –P.63–66. 27. Erkinjuntti T., Kurz A., Gauthier S. et al. Efficacy of galantamine in probable vascular dementia and Alzheimer’s disease combined with cerebrovascular disease: a randomised trial. //Lancet. –2002. –Vol.359. –№ 9314. –P.1283–1290. 28. Folstein M.F., S.E.Folstein, P.R.McHugh. Mini–Mental State: a practical guidefor grading the mental state of patients for the clinician. //J Psych Res. –1975. –V.12. –P.189–198. 29. Franco L., G.Cuny, F.M.C.Nancy. Multicentre study of the efficacy of TANAKAN (Egb 761) in the treatment of age–associated memory impairment. //Rev de Geriatrie. –1991. –V.4. –P.233–236. 30. Fu C., Chute D.J., Farag E.S., Garakian J. et al. Comorbidity in dementia: an autopsy study. //Arch Pathol Lab Med. –2004. –Vol.128. –№1. –P.32–38. 31. Gardes–Albert M., A.Khalil, A.Fortun et al. Protective effect of Ginkgo biloba extract (Egb 761) against the lipid peroxidation of low density lipoproteins initiated by .OH and .02 free radicals. //In: Y.Christen, Y.Courtois, M.T.Droy–Lefaix (eds) Effects of Ginkgo biloba extract (EGb 761) on aging and age– related disorders. Advances in Ginkgo biloba Extract Research. –V.4. Elsevier, Paris. –1995. –P.49–64. 32. Gardes–Albert M., C.Ferradini, A.Sekaki, M.T.Droy–Lefaix. Oxygen–centered free radicals and their interaction with Egb 761 or CP 202. //In: Ferradini C., M.T.Droy–Lefaix, Y.Christen (eds): Ginkgo biloba extract as free radical scavenger. Advances in Ginkgo biloba Extract Research. –1993. –V.2.–P.1–12. 33. Grylewski R.J., R.Korbut, J.Robak, J.Swies. On the mechanism of antithrombotic action of flavinoids. //Biochem Pharmacol. –1987. –V.36. –P.317–322. 34. Hachinski V. 35. Hachinski V.C., Lassen M.A., Marshall J. Multi–infarct dementia. A case of mental deterioration in the elderly. //Lancet. –1974. –V.2. –P.207–210. 36. Hershey L.A., Olszewski W.A. Ischemic vascular dementia. //In: Handbook of Demented Illnesses. Ed. by J.C.Morris. –New York etc.: Marcel Dekker, Inc. –1994. –P.335–351 37. Hofferberth B. The efficacy of Egb 761 in patients with senile dementia of the Alzheimer type, a double blind placebo–controlled study on different level of investigation. //Hum Psychopharmacol. –1994. –V.9. –P.215–222. 38. Holdago Madruga M., S. De Castro, J.F.Macias–Nunez. Effects of Ginkgo biloba extract (Egb 761) ob brain aging and oxygen free radicals metabolism in rat. //In: Y.Christen, Y.Courtois, M.T.Droy–Lefaix (eds): Effects of Ginkgo biloba extract (EGb 76 ) on aging and age– related disorders. Advances in Ginkgo biloba Extract Research. –V.4. Elsevier, Paris. –1995. –P.71–76. 39. Hulette C.M. Brain banking in the United States. //J Neuropathol Exp Neurol. –2003. –Vol.62. –N.7. –P.715–722. 40. Israel L., M.Myslinski, E.Dell’Accio et al. Onset of memory disorders: specific and combined contribution of memory–training programs and Ginkgo biloba (Egb 761) treatment. //In: Y.Christen, Y.Courtois, M.T.Droy–Lefaix (eds): Еffects of Ginkgo biloba extract (EGb 761) on aging and age–related disorders. Advances in Ginkgo biloba Extract Research. –V.4. Elsevier, Paris. –1995. –P.119–130. 41. Iqbal K., B.Winblad, T.Nishumura, , N.Takeda, H.Wishewski (eds). Alzheimer’s disease: biology, diagnosis and therapeutics. //J.Willey and sons ltd. –199714. 42. Kanowski S. Proof of efficacy of the Ginkgo biloba special extract (Egb 761) in outpatients suffering from primary degenerative dementia of the Alzheimer’s type and multi–infarct dementia. //In : Y.Christen, Y.Courtois, M.T.Droy–Lefaix (eds) :Effec s of Ginkgo biloba extract (EGb 761) on aging and age–related disorders. Advances in Ginkgo biloba Extract Research.–V.4. Elsevier, Paris. –1995. –P.149–158. 43. Knopman D.S., Parisi J.E., Boeve B.F. et al. Vascular dementia in a population–based autopsy study. //Arch Neurol. –2003. –Vol.60. –P.569–575. 44. Kumar V., Messina J., Hartman R., Cicin–Sain A. Presence of vascular risk factors in AD patients predicts greater response to cholinesterase inhibition. //Neurobiol. Aging. –2000. –Vol.21. –N.1S. –P.S218. 45. Packer L., N.Haramaki, T.Kawabata et al. Gingko biloba extract (EGb 761): antioxidant action and prevention of oxidative stress–induced injury. //In: Y.Christen, Y.Courtois, M.T.Droy–Lefaix (eds): Effects of Ginkgo biloba extract (EGb 761) on age and age– related disorders. Advances in Ginkgo biloba Extract Research. –V.4. Elsevier, Paris. –1995. –P.23–48. 46. Petersen R. S., Smith G. E., Waring S. C. et al Mild cognitive impairment: clinical characterization and outcome // Arch. Neurol. – 1999. – Vol. 56. – P. 303–308. 47. Rosvold H.E. The frontal lobe system: cortical–subcortical interrelationships. //Acta Neurobiol Exp. –1972.–V.32. –P.49–460. 48. Saint–Cyr J.A., A.E.Taylor, K.Nikolson. Behaviour and Вasal ganglia. //In: «Behavioral Neurology of Movement Disorder». W.J.Weiner, A.E.Lang (eds). –Adv Neurol. –1995. –V.65. –P.1–29.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Поделитесь статьей в социальных сетях
Порекомендуйте статью вашим коллегам