Мотонейро́н
(от лат. motor — приводящий в движение и нейрон;
двигательный нейро́н
) — крупная нервная клетка в передних рогах спинного мозга. Мотонейроны обеспечивают моторную координацию и поддержание мышечного тонуса[1][2].
Мотонейроны называют по той мышце, которую они иннервируют (четырёхглавые, икроножные, полусухожильные и т. п.)[2].
Различают альфа-мотонейроны и гамма-мотонейроны[1][2]:
| Вид | Функция |
| альфа-мотонейроны | иннервируют волокна скелетной мускулатуры (экстрафузальные волокна) и обеспечивают мышечное сокращение |
| гамма-мотонейроны | иннервируют рецепторы растяжения (интрафузальные волокна) |
Формы болезни мотонейронов
Болезни моторных нейронов классифицируются в зависимости от того, являются ли они наследуемыми или спорадическими, и зависит ли патология от верхних моторных нейронов или нижних моторных нейронов.
У взрослых наиболее распространенной формой болезни является боковой амиотрофический склероз (БАС), который поражает как верхние, так и нижние моторные нейроны. Болезнь имеет наследственные и спорадические формы и может затрагивать руки, ноги или мышцы лица.
Первичный боковой склероз является заболеванием верхних моторных нейронов, тогда как прогрессирующая мышечная атрофия затрагивает только более нижние двигательные нейроны в спинном мозге.
При прогрессирующем бульбарном параличе наиболее поражаются самые нижние двигательные нейроны ствола мозга, вызывающие такие симптомы, как невнятная речь, трудности при жевании и глотания.
Симптомы болезней мотонейронов
Ниже приводится краткое описание симптомов некоторых из наиболее распространенных форм болезней двигательных нейронов.
Боковой амиотрофический склероз (БАС), также называемый болезнью Лу Герига или классической болезнью моторных нейронов, является прогрессирующим, в конечном счете имеющим смертельный исход заболеванием, которое нарушает передачу сигналов во всех мышцах организма. Многие врачи используют термины «болезнь моторных нейронов» и БАС как взаимозаменяемые. Причиной болезни являются нарушения как верхних, так и нижних двигательных нейронов. Первые симптомы обычно отмечаются в руках и ногах или в мышцах, отвечающих за глотание. Примерно у 75 процентов больных классическим БАС развиваются слабость бульбарных мышц (мышцы, которые контролируют речь, глотание и жевание). Мышечная слабость и атрофия происходят по обе стороны тела. Больные теряют силу и способность двигать руками и ногами и удерживать тело в вертикальном положении. Другие симптомы включают в себя спастичность мышц, спазмы, мышечные судороги. Речь может стать невнятной или гортанной. Когда мышцы диафрагмы и грудной стенки не функционируют должным образом, больные теряют способность дышать без механической поддержки. Хотя болезнь как правило не нарушает интеллектуальные способности человека или личности, отдельные недавние научные исследования показывают, что у некоторые больных БАС могут развиваться когнитивные (умственные) нарушения. Большинство людей, страдающих боковым амиотрофическим склерозом, умирают от респираторной недостаточности, обычно через 3 — 5 лет с момента появления симптомов. Однако около 10 процентов больных выживают в течение 10 или более лет.
Прогрессивный бульбарный паралич, также называемый прогрессирующей атрофией бульбарной группы черепно-мозговых нервов, воздействует на нижние двигательные нейроны, отвечающие за такие действия, как глотание, речь, жевание и другие. Симптомы включают в себя слабость языкоглоточной мышцы, челюстной и лицевых мышц, прогрессирующую потерю функции речи и атрофию мышц языка. Слабость конечностей при заболевании с признаками повреждения двигательного нейрона почти всегда очевидна, но менее заметна. Люди подвержены повышенному риску удушья и аспирационной пневмонии, вызванной прохождением жидкостей и пищи через нижние дыхательные пути и легкие. У пострадавших присутствуют эмоциональные вспышки смеха или плача (называемые эмоциональной лабильностью). Инсульт и миастения могут иметь определенные симптомы, сходные с симптомами прогрессирующего бульбарного паралича и должны быть исключены при диагностике этого заболевания. Примерно у 25 процентов людей с БАС ранние симптомы начинаются с сопутствующим участием бульбарных нарушений. Многие клинические врачи считают, что прогрессирующий бульбарный паралич сам по себе, без признаков патологий в конечностях (руках или ногах), встречается крайне редко.
Псевдобульбарный паралич, имеющие многие симптомы, аналогичные прогрессирующему бульбарному параличу, характеризуется дегенерацией верхних моторных нейронов, которые передают сигналы нижним моторным нейронам в стволе мозга. У больных развивается прогрессирующая потеря способности говорить, жевать и глотать, а также прогрессивная слабость лицевых мышц. У больных могут развиться голосовые нарушения и повышенный рефлекс кляпа. Язык может стать неподвижным и потерять способность выступать из рта.
Первичный боковой склероз (ПБС) повреждает верхние двигательные нейроны рук, ног и лица. Это происходит, когда специфические нервные клетки в моторных областях коры головного мозга (тонкий слой клеток, покрывающих мозг, который отвечает за большинство функций мозга на высоком уровне) постепенно вырождаются, заставляя движения быть медленными. Болезнь часто затрагивает сначала ноги, а затем туловище, руки и, наконец, бульбарные мускулы. Речь может становится замедленной и вызывать сложности. При поражении нервных клеток движения ног и рук становятся неуклюжими, медленными и слабыми, возникает спастичность, что приводит к невозможности ходить или выполнять задачи, требующие точной координации рук. Проблемы с равновесием могут привести к падению. Речь может стать медленной и невнятной. Больные обычно испытывают псевдобульбарный аффект и чрезмерно активный ответ. Первичный боковой склероз чаще встречается у мужчин, чем у женщин, начало болезни обычно происходит между 40 и 60 годами. Причина заболевания неизвестна. Симптомы прогрессируют постепенно в течение многих лет, что приводит к прогрессивной жесткости (спастичности) и неуклюжести пораженных мышц. ПБС иногда считается формой бокового амиотрофического склероза, но основное отличие заключается в сохранении более низких моторных нейронов, медленной скорости прогрессирования заболевания и нормальной продолжительности жизни. Первичный боковой склероз может ошибочно приниматься за спастические параплегии, наследственное расстройство верхних моторных нейронов, которое вызывает спазм в ногах и как правило начинается в подростковом возрасте. Большинство неврологов следуют клиническому течению пострадавшего человека в течение как минимум 3-4 лет, прежде чем поставить диагноз. Данное заболевание не смертельно, но может оказывать влияние на качество жизни.
Прогрессивная мышечная атрофия характеризуется медленной, но прогрессирующей дегенерацией исключительно нижних моторных нейронов. Заболеванию подверждены в значительной степени мужчины, с началом заболевания раньше, чем при других болезнях мотонейронов. Слабость обычно возникает сначала в руках, а затем распространяется в нижнюю часть тела, где она может быть в более тяжелой форме. Другие симптомы могут включать в себя мышечное истощение, неуклюжие движения рук и мышечные судороги. Могут пострадать мышцы, отвечающие за дыхание. Воздействие холода может ухудшить симптомы. Болезнь развивается совместно с БАС во многих случаях.
Спинальная мышечная атрофия (СМА) является наследственной болезнью, воздействующей на нижние двигательные нейроны. Это аутосомно-рецессивное заболевание, причиной которого являются нарушения в гене SMN1 (ген ответственный за производтсво белка, который важен для функционирования моторных нейронов (SMN-белок)). При СМА недостаточный уровень белка SMN приводят к дегенерации нижних моторных нейронов, вызывая слабость и истощение скелетных мышц. Слабость часто более выражена в мышцах рук и ног, а также в мышцах туловища. Спинальная мышечная атрофия у детей подразделяется на три типа, исходя из возраста начала, тяжести и прогрессирования симптомов. Все три типа вызваны дефектами в гене SMN1.
Синдром постполиомиелита (СПП) — это состояние, которое может поражать больных, перенесших полиомиелит, что может произойти в течение десятилетий после их выздоровления от полиомиелита. Полиомиелит — острое вирусное заболевание, которое разрушает моторные нейроны. Многие люди, пострадавшие от заболевания на ранней стадии жизни, восстанавливаются, а новые симптомы возникают спустя много десятилетий. После острого полиомиелита выжившие двигательные нейроны отвечают за большее количество мышц, которые они контролируют. Считается, что синдром постполиомиелита и постполиотическая мышечная атрофия возникают, когда выжившие моторные нейроны утрачиваются в процессе старения или вследствие травмы/болезни. Многие ученые считают, что СПП является скрытым симптомом слабости мышц, ранее пораженных полиомиелитом, а не новой болезнью моторных нейронов. К симптомам относится усталость, медленно прогрессирующая мышечная слабость, мышечная атрофия, непереносимость холода, боль в мышцах и суставах. Эти симптомы чаще всего проявляются среди групп мышц, пораженных начальным заболеванием, и могут состоять из проблем при дыхании, глотании или во время сна. Другие симптомы СПП могут быть вызваны скелетными деформациями, такими как давно сформировавшийся сколиоз, которые привели к хроническим изменениям в биомеханике суставов и позвоночника. Симптомы чаще встречаются у пожилых людей и тех лиц, которые в наибольшей степени страдают от более раннего заболевания. У некоторых людей наблюдаются только незначительные симптомы, в то время как у других развивается мышечная атрофия, которую можно ошибочно диагностировать как БАС. СПП как правило не угрожает жизни больного. По медицинской статистике, у 25 — 50 процентов перенесших паралитический полиомиелит обычно развивается синдром постполиомиелита.
Двигательные единицы (ДЕ)
Дано понятие двигательной единицы (ДЕ) и описана ее структура. Приведена классификация ДЕ и соответствие ДЕ и типов мышечных волокон. Описан принцип размера и правило Хеннемана. Приведены данные об активации ДЕ при выполнении силовых упражнений в зависимости от величины отягощения.
Определение
Термин «двигательная единица» был предложен Е. Г. Лидделом и Ч.С. Шеррингтоном для обозначения группы мышечных волокон, иннервируемых терминалями (веточками) одного аксона.
В настоящее время под двигательной единицей (ДЕ) понимается элементарная функциональная единица мышцы, включающая в себя мотонейрон и иннервируемые им мышечные волокна.
Структура ДЕ
Войдя в мышцу, аксон мотонейрона разветвляется на множество веточек, каждая из которых иннервирует отдельное мышечное волокно. Таким образом, один мотонейрон иннервирует достаточно большое количество мышечных волокон (от нескольких единиц до нескольких тысяч), в то время как каждое мышечное волокно иннервируется только одним двигательным нейроном.
Установлено, что мышечные волокна, принадлежащие к одной ДЕ, рассредоточены по всей мышце, то есть принадлежат к разным мышечным пучкам.
Такое рассредоточенное (дисперсное) распределение мышечных волокон каждой ДЕ обеспечивает равномерное сокращение мышцы, когда в работу «включается» лишь некоторая часть ДЕ.
Следует отметить, что в одну ДЕ составляют мышечные волокна, обладающие одинаковыми свойствами. Посредством активации различных ДЕ центральная нервная система управляет активностью всей мышцы.
Размер ДЕ (иннервационное отношение, коэффициент иннервации)
Размер ДЕ — это количество мышечных волокон, которые иннервируются одним мотонейроном. Чтобы определить этот показатель определяют количество мышечных волокон в скелетной мышце и количество мотонейронов, которые инннервируют эти мышечные волокна (табл.1). Иногда в литературе размер ДЕ называют иннервационным отношением или коэффициентом иннервации.
Всякий раз, когда активируется мотонейрон, он посылает потенциалы действия ко всем мышечным волокнам, которые он иннервирует.
Поэтому, чем ниже коэффициент иннервации, тем совершеннее контроль со стороны нервной системы за мышечными волокнами.
По коэффициенту иннервации (размеру ДЕ) можно судить о количестве веточек, необходимых аксону мотонейрона, чтобы иннервировать все входящие в ДЕ мышечные волокна.
Табл. 1 — Количество мышечных волокон, количество ДЕ (мотонейронов) и размер ДЕ в различных скелетных мышцах человека
| Мышца | Количество мышечных волокон | Количество ДЕ | Размер ДЕ |
| Передняя большеберцовая | 250090 | 445 | 562 |
| Медиальная головка икроножной мышцы | 1120365 | 1934 | 579 |
| Наружная прямая мышца глаза | 26730 | 2970 | 9 |
| Плечелучевая | 136530 | 333 | 410 |
С возрастом количество ДЕ, приходящихся на одну мышцу уменьшается. Это связано с тем, что уменьшается количество мотонейронов, которые иннервируют отдельную мышцу. Вследствие этого количество мышечных волокон по мере старения организма человека также уменьшается.
Классификации ДЕ
Существуют различные классификации ДЕ. Исходя из значимости для организма, Р. Берк с соавт. (R.E. Burke, 1973) предложил разделять ДЕ по сочетанию двух признаков – скорости сокращения и устойчивости к утомлению.
По этой классификации ДЕ делятся на три типа: S (slow) – медленные, устойчивые к утомлению; FR (fast resistant) – быстрые, устойчивые к утомлению, FF (fast fatigable) – быстрые, быстроутомляемые.
Этим ДЕ соответствуют различные типы мышечных волокон (табл. 1).
Таблица 1 — Соответствие типов ДЕ и мышечных волокон
| Тип ДЕ | S | FR | FF |
| Тип мышечного волокна | I тип | IIA тип | IIB тип |
Строение и функции мотонейрона соответствуют морфологическим характеристикам мышечных волокон, которые он иннервирует. Так, мотонейрон ДЕ S типа имеет небольшое клеточное тело и иннервирует от 10 до 180 мышечных волокон, а мотонейрон ДЕ FF типа имеет большое клеточное тело и иннервирует от 300 до 800 мышечных волокон (Дж.Х. Уилмор, Д.Л. Костилл, 1997) (рис.1).
Рис. 1. Гистохимические и физиологические свойства трех основных типов ДЕ и мышечных волокон (R.E. Burke, 1973)
В табл. 2 представлено количество мышечных волокон и количество ДЕ в различных мышцах человека
Принцип размера или правило Хеннемана
ДЕ S типа имеют низкий порог активации, поэтому при развитии силы мышцы они включаются в работу первыми. После этого активируются ДЕ FR типа. ДЕ FF типа обладают высоким порогом активации, поэтому при развитии усилия в мышце они активируются последними.
Благодаря тому, что мышечные волокна, принадлежащие различным ДЕ, рассредоточены по всей мышце, а не находятся в одном пучке, развитие силы мышцы характеризуется плавностью.
Однако из-за того, что между соседними мышечными волокнами существуют соединительнотканные связи, при сокращении одних мышечных волокон, например, входящих в состав ДЕ S типа, и расслабленном состоянии других (например, входящих в состав ДЕ FF типа) должны возникать силы трения, обусловливающие высокую вязкость мышцы. Г.В.
Васюков (1967) показал, что при небольших напряжениях мышцы (30% от максимума) вязкость мышцы максимальна. При дальнейшем напряжении мышцы, когда одновременно возбуждено много мышечных волокон, вязкость мышцы скачкообразно уменьшается.
Более подробно строение и функции мышц описаны в моих книгах “Гипертрофия скелетных мышц человека” и “Биомеханика мышц”
Диагностика болезни моторных нейронов
Не существует каких-либо специальных исследований для диагностики большинства болезней мотонейронов, хотя в настоящее время существуют генетическое тестирование для генов SMA. Симптомы могут различаться у больных и на ранних стадиях заболевания могут быть похожими на симптомы других заболеваний, что затрудняет диагностику. За физическим осмотром следует тщательное неврологическое обследование. Неврологические тесты будут оценивать двигательные и сенсорные навыки, функционирование нервной системы, слух и речь, зрение, координацию и равновесие, психическое состояние и изменения настроения или поведения.
Исследования для исключения других заболеваний или измерения степени поражения мышц, могут включать следующие:
Электромиография (ЭМГ) используется для диагностики расстройств нижних моторных нейронов, а также нарушений мышц и периферических нервов. При ЭМГ врачом вводится тонкий игольчатый электрод, прикрепленный к регистрирующему инструменту, в мышцу для оценки электрической активности во время произвольного сокращения и в состоянии покоя. Электрическая активность в мышце вызвана более нижними двигательными нейронами. Когда двигательные нейроны утрачиваются, в мышце возникают характерные аномальные электрические сигналы. Тестирование обычно длится около часа или более, в зависимости от количества тестируемых мышц и нервов.
ЭМГ как правило проводится в сочетании с исследованием скорости нервной проводимости. Исследования нервной проводимости измеряет скорости передачи импульсов в нервах от небольших электродов, прикрепленных к коже, а также их силу. Небольшой импульс электричества (подобный толчке от статического электричества) стимулирует нерв, который отвечает за конкретную мышцу. Второй комплект электродов передает ответный электрический сигнал на записывающее устройство. Исследования нервной проводимости помогают дифференцировать болезни нижних моторных нейронов от периферической невропатии и могут обнаруживать нарушения в сенсорных нервах.
Лабораторные анализы крови, мочи и других веществ позволяют исключить мышечные заболевания и другие расстройства, которые могут иметь симптомы, сходные с симптомами болезни мотонейронов. Например, анализ спинномозговой жидкости, которая окружает мозг и спинной мозг, может обнаруживать инфекции или воспаление, которые также могут вызывать мышечную жесткость. Анализы крови могут назначаться для измерения уровней белковой креатинкиназы (необходима для химических реакций, которые вырабатывают энергию для мышечных сокращений); высокие уровни позволяют диагностировать мышечные заболевания, такие как мышечная дистрофия.
Магнитно-резонансная томография (МРТ) использует мощное магнитное поле для получения детальных изображений тканей, органов, костей, нервов и других структур тела. МРТ часто используется для исключения болезни, которые воздействуют на голову, шею и спинной мозг. МРТ-изображения позволяют диагностировать опухоли головного и спинного мозга, заболевания глаз, воспаление, инфекцию и сосудистые нарушения, которые могут привести к инсульту. МРТ также может обнаруживать и контролировать воспалительные заболевания, такие как рассеянный склероз. Магнитно-резонансная спектроскопия — это тип МРТ-сканирования, который измеряет уровень химических веществ в головном мозге и может использоваться для оценки целостности верхних моторных нейронов.
Биопсия мышц или нервов позволяет подтвердить наличие неврологических нарушений, в частности нарушения регенерации нервов. Небольшой образец мышечной или нервной ткани берется под местным анестетиком и исследуется под микроскопом. Образец может быть удален хирургическим путем через разрез на коже или путем биопсии, при которой тонкая полая игла вводится через кожу в мышцу. Небольшая часть мышечной ткани остается в полой игле, когда она удаляется из тела. Хотя это исследование может предоставить ценную информацию о степени повреждения, это инвазивная процедура, и многие эксперты считают, что биопсия не всегда необходима для диагностики.
Транскраниальная магнитная стимуляция была впервые разработана как диагностический инструмент для изучения областей головного мозга, связанных с двигательной активностью. Она также используется в качестве лечения некоторых заболеваний. Эта неинвазивная процедура создает магнитный импульс внутри мозга, который вызывает двигательную активность в области тела. Электроды, прикрепленные к различным областям тела, собирают и регистрируют электрическую активность в мышцах. Меры вызванной активности могут диагностировать двигательную нервную дисфункцию при болезни мотонейронов или в мониторинге прогрессирования заболевания.
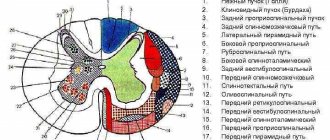
Проводящие пути спинного мозга
text_fields
text_fields
arrow_upward
Аксоны спинальных ганглиев и серого вещества спинного мозга идут в его белое вещество, а затем в другие структуры ЦНС, создавая тем самым так называемые проводящие пути,
функционально подразделяющиеся на
- Проприоспинальные,
- Спиноцеребральные,
- Цереброспинальные.
1. Проприоспинальные пути
связывают между собой нейроны одного или разных сегментов спинного мозга. Они начинаются от нейронов серого вещества промежуточной зоны, идут в белое вещество латерального или вентрального канатиков спинного мозга и заканчиваются в сером веществе промежуточной зоны или на мотонейронах передних рогов других сегментов. Функция таких связей ассоциативная и заключается в координации позы, тонуса мышц, движений разных метамеров туловища. К проприоспинальным путям относятся также комиссуральные волокна, соединяющие функционально однородные симметричные и несимметричные участки спинного мозга.
2. Спиноцеребральные пути
соединяют сегменты спинного мозга со структурами головного мозга.
Они представлены
- проприоцептивным,
- спиноталамическим,
- спиномозжечковым,
- спиноретикулярным путями.
Проприоцептивный путь
начинается от рецепторов глубокой чувствительности мышц сухожилий, надкостницы, оболочек суставов. Через спинальный ганглий он идет в задние корешки спинного мозга, в белое вещество задних канатиков, поднимается в ядра Голля и Бурдаха продолговатого мозга. Здесь происходит первое переключение на новый нейрон, далее путь идет в латеральные ядра тала-муса противоположного полушария мозга, переключается на новый нейрон — второе переключение. От таламуса путь поднимается к нейронам соматосенсорной коры. По ходу волокна этих трактов отдают коллатерали в каждом сегменте спинного мозга, что создает возможность коррекции позы всего туловища. Скорость проведения возбуждения по волокнам этого тракта достигает 60-100 м/сек.
Спиноталамический путь
начинается от болевых, температурных, . тактильных, барорецепторов кожи. Сигнал от рецепторов кожи идет в спинальный ганглий, далее через задний корешок к заднему рогу спинного мозга (первое переключение). Чувствительные нейроны задних рогов посылают аксоны на противоположную сторону спинного мозга и поднимаются по боковому канатику к таламусу (скорость проведения возбуждения по ним — 1-30 м/с) (второе переключение), затем — в сенсорную кору. Часть волокон кожных рецепторов идет к таламусу по переднему канатику спинного мозга. Соматовисцеральные афференты идут также по спиноретикулярному пути.
Спиномозжечковые пути
начинаются от рецепторов мышц, связок, внутренних органов и представлены неперекрещивающимся пучком Говерса и дважды перекрещивающимся пучком Флексига. Следовательно, все спиномозжечковые пути, начинаясь на левой стороне тела, заканчиваются в левом мозжечке, точно также и правый мозжечок получает информацию только со своей стороны тела. Эта информация идет от сухожильных рецепторов Гольджи, проприорецепторов, рецепторов давления, прикосновения. Скорость проведения возбуждения по этим трактам достигает 110-120 м/с.
3. Цереброспинальные пути
начинаются от нейронов структур головного мозга и заканчиваются на нейронах сегментов спинного мозга.
Сюда относятся пути:
- кортикоспинальный
(от пирамидных нейронов пирамидной и экстрапирамидной коры), который обеспечивает регуляцию произвольных движений; - руброспинальный,
- вестибулоспинальный,
- ретикулоспинальный пути —
регулирующие тонус мускулатуры.
Объединяющим для всех перечисленных путей является то, что конечным их пунктом являются мотонейроны передних рогов
.
Периферические мотонейроны подразделяются на альфа-мотонейроны и гамма-мотонейроны (рис. 21.2).
Меньшие по размеру гамма-мотонейроны иннервируют интрафузальные мышечные волокна. Активация гамма-мотонейронов увеличивает растяжение мышечных веретен, тем самым облегчаясухожильные и другие рефлексы, замыкающиеся через альфа-мотонейроны.
Каждую мышцу иннервирует несколько сотен альфа-мотонейронов. В свою очередь, каждый альфа-мотонейрон иннервирует множество мышечных волокон — около двадцати в наружных мышцах глаза и сотни в мышцах конечностей и туловища.
В нервно-мышечных синапсах выделяется ацетилхолин.
Аксоны периферических мотонейронов идут в составе черепных нервов и передних корешков спинного мозга. На уровне межпозвоночных отверстий передние корешки и задние корешкисливаются, образуя спинномозговые нервы. Несколько соседних спинномозговых нервов образуют сплетение, а затем разветвляются на периферические нервы. Последние тоже неоднократно разветвляются и иннервируют несколько мышц. Наконец, аксон каждого альфа-мотонейрона образует многочисленные разветвления, иннервируя многие мышечные волокна.
Каждый альфа-мотонейрон получает прямые возбуждающие глутаматергические входы откорковых мотонейронов и от чувствительных нейронов, иннервирующих мышечные веретена. Возбуждающие влияния поступают также к альфа- и гамма-мотонейронам от двигательных ядер ствола мозга и вставочных нейронов спинного мозга — как по прямым путям, так и с переключениями.
Прямое постсинаптическое торможение альфа-мотонейронов осуществляют клетки Реншоу — вставочные глицинергические нейроны. Непрямое пресинаптическое торможение альфа-мотонейронов и непрямое пресинаптическое торможение гамма-мотонейронов обеспечивают другие нейроны, образующие ГАМКергические синапсы на нейронах задних рогов.
Тормозное действие на альфа- и гамма-мотонейроны оказывают и другие вставочные нейроны спинного мозга, а также двигательные ядра ствола мозга.
Если преобладают возбуждающие входы, группа периферических мотонейронов активируется. Вначале возбуждаются мелкие мотонейроны. По мере того как сила сокращения мышцы нарастает, частота их разрядов нарастает и вовлекаются крупные мотонейроны. При максимальном сокращении мышцы возбуждена вся соответствующая группа мотонейронов.