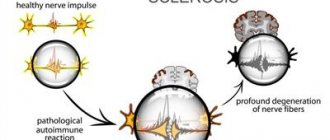
Рассеянный склероз (РС) впервые стал известен человечеству, как отдельная нозология, в 1868 году. Несмотря на то, что человек столь длительный период сталкивается с этим заболеванием, до сих пор остаются неизвестными до конца причины его возникновения и способы лечения (ни один случай рассеянного склероза не удалось полностью вылечить).
Лишь с конца двадцатого века больным стали доступны новые препараты, изменяющие течение рассеянного склероза (ПИТРС), которые при некоторых типах протекания болезни способны приостановить ее развитие и сохранить пациенту работоспособность.
У каждого больного с диагнозом РС возникает вопрос, какие же «за» и «против» применения ПИТРС?
Что представляют собой ПИТРС
Поскольку РС относится к аутоиммунным заболеваниям, это подразумевает сбои в работе иммунной системы. Ученые пришли к выводу, что в основу лечения следует включить иммуномодулирующие средства, в принцип действия которых заложено влияние на активность иммунной системы.
В группу ПИТРС входят лекарства, содержащие такие действующие вещества:
- интерферон бета-1а;
- интерферон бета-1b;
- глатирамера ацетат;
- терифлунамид;
- финголимод;
- митоксантрон;
- натализумаб.
Моноклональные антитела (МА)
Иммунная система человека производит большое количество различных антител для борьбы с антигенами разных видов. Реакция иммунной системы на любой из антигенов является поликлональной. Моноклональные антитела – это клетки-клоны, синтезированные в лабораторных условиях.
Препараты моноклональных антител обладают способностью воздействия на антигены, которые необходимо удалить из организма. Они атакуют миелин, связываются с антигенами и впоследствии выводятся из организма, не причиняя ему вреда. Помимо этого, МА активируют работу иммунной системы в отношении чужеродных антигенов. При попадании в организм они «побуждают» другие компоненты иммунной системы уничтожать целевые агенты (к примеру, раковые клетки).
Сегодня в Израиле для лечения рассеянного склероза успешно используется новый препарат Лемтрада (алемтузумаб или Campath-1H). Изначально его разрабатывали для лечения онкологических заболеваний – лейкимии и лимфомы. Но механизм действия препарата таков, что предотвращает атаку миелина, тем самым блокируя новые повреждения при рассеянном склерозе.
Наблюдения в течение 7 лет за пациентами, принимающими Лемтрада, показали общее улучшение и стабилизацию их состояния. Вероятность рецидивов снизилась на 50 %, а прогрессирование инвалидности – на 42%. После приема Лемтрады, как и других лекарств, могут возникнуть побочные эффекты. Наиболее распространённые из них:
- головная боль;
- сыпь, крапивница;
- лихорадка;
- бессонница;
- инфекции верхних дыхательных путей;
- герпес;
- расстройство свёртываемости крови;
- синусит.
В редких случаях могут возникнуть проблемы со щитовидной железой. Но все побочные явления поддаются лечению при своевременном обращении к врачу.
Исследования, подтверждающие эффективность иммуномодуляторов
Первый ПИТРС был зарегистрирован в 1993 году и с тех пор произошел существенный прорыв в лечении заболевания. Новые и высокоэффективные медикаменты, относящиеся к группе ПИТРС, постоянно продолжают создаваться. Широкий спектр препаратов, имеющихся в наличии в настоящее время, доказывает свою эффективность, что подтверждается многими международными исследованиями.
Исследования безопасности и эффективности иммуномодуляторов в лечении РС, сравнительные в том числе, проводятся с конца 1990-х лет.
Ключевые исследования:
- После утверждения FDA (Food and Drug Administration) в 1993 году бетаферона (интерферон бета-1b) препаратом для лечения ремиттирующего рассеянного склероза, в течение 16 лет в одиннадцати центрах лечения США проведено исследование, доказавшее эффективность и безопасность применения данного действующего вещества при лечении ремиттирующего типа заболевания. На протяжении всего исследования отмечалось замедление прогрессирования заболевания и снижение частоты обострений.
- Исследование BENEFIT (BEtaferon in Newly Emerging MS For Initial Treatment) доказало уместность назначения бетаферона после клинического изолированного синдрома.
- При применении препарата в течение двух лет риск развития рассеянного склероза в два раза ниже. Современная медицина рекомендует назначать бетаферон после первого эпизода заболевания.
- Исследованием 2004 года на базе Российского медицинского университета в Москве в рамках докторской диссертации на тему «Исследование показателей качества жизни и фармакоэкономический анализ у больных рассеянным склерозом» доказано, что применение ПИТРС с такими действующими веществами как глатирамера ацетат, интерферон бета-1а, интерферон бета-1b предотвращает инвалидизацию за год в среднем на 45%.
- Новое направление получили фармакогенетические исследования, основанные на фармакогенетическом анализе. В их ходе изучают эффективность препаратов в зависимости от генетических особенностей заболевших. Определив гены, которые влияют на эффективность иммуномодуляторов, ученые смогут прогнозировать не только клинические эффекты индивидуально подобранного лекарственного средства, но и прогнозировать возможные побочные реакции. Результатом исследований станет возможность осуществления лечения РС с учетом индивидуальных особенностей.
Однако, следует заметить, что ни один препарат еще не обеспечил полного выздоровления от заболевания.
Разрабатываемые и внедряемые в настоящее время медикаментозные препараты обладают мощным и узконаправленным действием на течение неврологической патологии. Однако расширение возможностей лекарственной терапии привело к появлению новых побочных эффектов и поставило вопрос о безопасности и переносимости подобных медикаментов.
Особенно остро эта проблема проявляется, когда для достижения и поддержания желаемого эффекта медикаментозная терапия должна продолжаться непрерывно и длительно. В этих случаях благоприятный профиль безопасности лекарственного средства (показатель риск/польза) играет, вероятно, самую значимую роль в поддержании высокого уровня приверженности пациента лечению и достижении долгосрочной эффективности терапии. Часто наличие нежелательных побочных реакций (НПР) — любых непреднамеренных и вредных для организма человека проявлений, возникающих при использовании препарата в обычных дозах с целью профилактики, лечения и диагностики [35], — сводит к минимуму эффективность терапии в силу снижения приверженности или полного отказа пациента от лечения. Согласно наиболее распространенной классификации НПР Комитета экспертов ВОЗ, выделяют следующие категории: тип А — зависимые от дозы; тип В — не зависимые от дозы; тип С — эффекты при длительном применении (синдром отмены); тип D — отсроченные эффекты [11]. Около 80% всех НПР относится к типу А и касается наиболее часто назначаемых препаратов.
Введение в терапию ремиттирующего рассеянного склероза (РС) препаратов, изменяющих его течение (ПИТРС), привело к переходу от симптоматического лечения к патогенетической терапии. ПИТРС, согласно полученным в экспериментальных и масштабных клинических исследованиях (КИ) данным, в той или иной мере способствуют замедлению прогрессирования заболевания, уменьшению выраженности и снижению риска развития обострений, а также положительно влияют на динамику очагов демиелинизации по данным нейровизуализации [7].
По данным на сентябрь 2011 г., в мире зарегистрировано семь оригинальных препаратов для лечения ремиттирующего РС, в III фазе клинических исследований находятся еще около десяти препаратов. Большинство из них требует непрерывного применения в течение продолжительного периода времени. К препаратам «золотого стандарта» первой линии терапии в настоящий момент относят интерферон (ИФН) β-1b (бетаферон, «Bayer»), ИФН β-1а для подкожного (ребиф, «Merck Serono») и внутримышечного введения (авонекс, «Biogen Idec»), а также глатирамера ацетат (копаксон, «Teva»). В России, в дополнение к ним, также зарегистрирован ряд биоаналогов оригинальных препаратов — ИФН β-1b (экставиа, «Novartis»; ронбетал, «Биокад»; инфибета, «Фармстандарт»), ИФН β-1а для подкожного (генфаксон, «MR Pharma S.A.») и ИФН β-1а для внутримышечного введения (синновекс, «CinnaGen»).
Спектр наиболее частых побочных эффектов терапии ИФН и глатирамера ацетатом включает в себя как реакции в месте инъекции, так и генерализованные системные проявления. Однако следует иметь в виду, что КИ являются своего рода «чистым» экспериментом, в более полном виде «пейзаж» нежелательных реакций на лекарственный препарат предстает взору врача лишь спустя несколько лет после использования его в реальной клинической практике, о чем свидетельствуют различия, указанные в таблице
| Таблица |
[1, 6, 8, 10, 14, 16—21, 23, 25, 28, 30—32].
Местные реакции
. Учитывая инъекционный способ применения ПИТРС, наиболее частыми НПР являются реакции в месте инъекции — гиперемия, зуд, отек, боли, которые могут возникать как в момент введения препарата, так и отсроченно. В основе патогенеза местных реакций лежит выделение медиаторов воспаления на внедрение чужеродного макромолекулярного объекта, однако важную роль играет не только состояние организма, но и ряд характеристик лекарственного средства (рН, диаметр иглы), техника выполнения инъекции, а также, вероятно, неполная биологическая эквивалентность молекул [27]. Так, по данным КИ III фазы, при использовании ИФН β-1b 250 мкг подкожно через день, встречаемость данной НПР составила 69%, ИФН β-1а 44 мг подкожно 3 раза в неделю — 85%, ИФН β-1а 30 мг внутримышечно 1 раз в неделю — 33%, глатирамера ацетата подкожно ежедневно — 57% [18, 26, 31]. Уменьшение выраженности местных реакций возможно путем использования соответствующих приспособлений для инъекций и игл меньшего диаметра, а также местным применением противовоспалительных средств и анестетиков. Некрозы в местах инъекций встречаются относительно редко, частота их не превышает 1—3%, липоатрофии в виде локальной атрофии подкожной жировой клетчатки специфичны для глатирамера ацетата — 15% [10] и в редких случаях имеют место при использовании подкожных ИФН [5].
Системные реакции
. Наиболее распространенной системной реакцией на препараты ИФН является гриппоподобный синдром в виде повышения температуры тела, озноба, головной боли. Патогенез развития данного состояния связан с изменением баланса цитокинов и непосредственным пирогенным влиянием на ЦНС (гипоталамус) [9]. Часто, особенно при длительном использовании, системные реакции на введение ИФН могут проявляться миалгиями, слабостью, преимущественно в ногах, чувством усталости. Встречаемость гриппоподобного синдрома при терапии ИФН β-1b по данным КИ III фазы составила 52—77%, ИФН β-1а для подкожного введения — 45—69%, ИФН β-1а для внутримышечного введения — 53—76% [13, 16, 26]. При этом имеется связь выраженности синдрома с возрастом пациента (он встречается у 60% пациентов в возрасте 18—28 лет и только у 37% — в возрасте 42—50 лет), с индексом массы тела (чем выше масса тела, тем меньше вероятность развития синдрома) и длительностью использования (в среднем через 1 год терапии частота гриппоподобного синдрома составляет 22—34%) [13, 16, 26]. Коррекция состояния достигается профилактическим приемом антипиретиков (парацетамол, ибупрофен) и перенесением времени инъекции на вечер. Гриппоподобный синдром является одной из самых частых причин прекращения терапии ПИТРС [26].
Такие системные НПР, как депрессия и суицидальное поведение, также оказывают влияние на качество жизни пациентов. Показано, что использование препаратов ИФН повышает риск развития депрессии, при этом использование глатирамера ацетата не приводит к подобному эффекту [4, 6, 29].
Для глатирамера ацетата наиболее значимой системной реакцией на препарат является постинъекционная реакция — боль в груди, учащенное сердцебиение, состояние тревоги, одышка, затрудненное глотание; по данным КИ III фазы, встречаемость данного состояния составила 15% [19]. Механизм возникновения реакции, вероятно, связан с «цитокиновым штормом» в ответ на введение глатирамера ацетата и является главной причиной отказа пациентов от терапии.
Параклинические реакции
. Среди параклинических НПР на фоне использования ИФН наиболее часто встречаются повышение уровня печеночных ферментов, нейтро-, лимфо-, реже — тромбоцитопения. Изменение этих показателей может служить критерием токсичности данной дозы лекарственного преперата.
Повышение уровня печеночных ферментов, в первую очередь аланин-аминотрансферазы (АлАТ), реже аспартат-аминотрансферазы (АсАТ), в большинстве случаев не имеет клинических проявлений и, по данным КИ III фазы, обычно встречается в первые 12 нед от начала терапии. Так, при использовании ИФН β-1b повышение уровня АлАТ в первые 12 нед наблюдалось у 20%, а АсАТ — у 9% пациентов, спустя 5 лет подобные отклонения отмечались лишь у 4 и 0% пациентов соответственно [16]. В течение 6 лет проведения КИ 3 фазы ИФН β-1а для внутримышечного введения транзиторное повышение уровня АлАТ и АсАТ было выявлено у 44 и 27% пациентов соответственно [14], а ИФН β-1а для подкожного введения 44 мкг — соответственно у 23 и 54% [21]. Обычно повышение АлАТ и АсАТ соответствует 1-му уровню токсичности и не требует изменения схемы терапии [33].
Изменения со стороны гемограммы более характерны для отдаленного периода терапии: нейтропения, как правило, возникает после 1-го года терапии и длится до 5 лет; лимфопения возникает позже, однако продолжается более длительное время. Несмотря на относительно частую встречаемость этих состояний у пациентов, получающих ПИТРС, они не приводят к возникновению клинической симптоматики [34]. В течение первых 2 лет КИ снижение уровня лейкоцитов отмечалось у 20% больных, получавших ИФН β-1а для подкожного введения по 22 мкг, и 27% — получавших ИФН β-1а для подкожного введения по 44 мкг [13].
В отношении глатирамера ацетата подобных изменений активности печеночных ферментов и снижения содержания клеток крови при КИ и последующем использовании препарата выявлено не было [20].
Биоаналоги
. Анализ литературы для сопоставления побочных эффектов оригинальных препаратов и биоаналогов сложен, так как имеются лишь результаты отдельных исследований по биоэквивалентности данных препаратов, что в силу ограниченности выборки не позволяет сделать окончательные выводы.
Для биоаналога ИФН-β-1b экставиа нами были обнаружены данные о трех двойных слепых плацебо-контролируемых КИ, проведенных в США, Канаде и Евросоюзе — при ремиттирующем РС (n=372) [22], вторично-прогрессирующем РС (n=718) [12] и клинически изолированном синдроме (n=468) [21]. Выявлено, что местные реакции в виде гиперемии и боли в месте инъекции имели место в 48—85% случаев, некрозы — в 1—5% случаев, при этом было отмечено, что частота местных реакций снижается при длительном использовании препарата; так, через 6 мес они наблюдались только у 21—47% пациентов. Гриппоподобный синдром встречался в 61—76% случаев, что сопоставимо с оригинальным препаратом. Лейкопения и нейтропения на фоне приема биоаналога ИФН β-1b составили 82 и 18% соответственно, достигая лишь 1-й степени токсичности, значимое повышение АлАТ наблюдалось у 19% пациентов. В доступной литературе нет данных прямых сравнительных исследований экставии и оригинального препарата ИФН β-1b, по результатам косвенного сравнения плацебо-контролируемых исследований препараты не имеют существенных различий в профиле.
В открытом сравнительном многоцентровом исследовании препарата биоаналога ИФН β-1b ронбетала, по данным отчета , участвовали 36 пациентов (препарат сравнения — бетаферон). При этом встречаемость гриппоподобного синдрома достоверно различалась: так, синдром зарегистрирован в 31,4% случаев при использовании ронбетала против 90,9% на фоне бетаферона. Местные побочные эффекты достоверных отличий не продемонстрировали: болезненность в месте инъекции на фоне ронбетала и бетаферона — 14,3 и 9,1% соответственно, гиперемия места инъекции — в 62,7 и 81,8% соответственно. Аналогичным образом не различались и параклинические эффекты.
В открытом исследовании безопасности и переносимости биоаналога ИФН β-1а для подкожного введения генфаксона в дозе 44 и 22 мкг принимали участие 68 пациентов [15]. При использовании препарата были выявлены побочные реакции: гриппоподобный синдром наблюдался у 20,6% (n=14) пациентов, гиперчувствительность — у 7,4% (n=5), реакции со стороны других систем (без уточнения) — у 4,4% (n=3). Местные реакции (без уточнения) отмечены в 42,7% (n=29). У 54,4% пациентов побочных реакций выявлено не было. При сравнении этого исследования с исследованием PRISMS [32] и данными инструкции FDA к ребифу [24], установлено, что гриппоподобный синдром при использовании ребифа имел место в 69% случаев (в 3 раза чаще, чем на фоне генфаксона), местные реакции — в 72% (почти в 2 раза выше, чем при приеме генфаксона). При этом частота повышенной чувствительности к компонентам препарата была выше при использовании генфаксона (для ребифа — 2%). Таким образом, профиль безопасности при сравнении этих препаратов достаточно выраженно отличался.
Информация по КИ препаратов инфибета и синновекс на настоящий момент авторам статьи недоступна.
Цель исследования — сравнительный анализ ПИТРС и биоаналогов.
Материал и методы
Учитывая сложность оценки переносимости биоаналогов в сравнении с оригинальными препаратами по данным КИ, также с целью изучения профиля безопасности зарегистрированных на настоящее время ПИТРС, нами была проанализирована информация катамнестического наблюдения за пациентами, получавшими такую терапию в Ярославской области в период с 2009 по 2011 г. Общее количество включенных в анализ пациентов составило 230 человек, случаев использования ПИТРС — 401 (некоторые пациенты имели анамнез использования нескольких препаратов). В анализ вошли данные о больных, получавших препараты ИФН β-1а для внутримышечного введения (авонекс — 3,0%), ИФН β-1а для подкожного применения (ребиф —19,2%, генфаксон — 8,5%), ИФН β-1b (бетаферон — 16,5%, экставиа — 18,2%, ронбетал — 18,0%), а также глатирамера ацетата (копаксон — 16,7%). Фиксировались нежелательные явления, выявляемые при расспросе и осмотре пациента, также оценивалась субъективная переносимость препарата.
Для статистической обработки полученных данных, учитывая дихотомичность деления (есть эффект/нет эффекта) и непараметричность выборки, использовали точный критерий Фишера.
Результаты
В целом следует отметить, что препараты имеют хорошую переносимость при длительном применении: только в 21,9% случаев терапия ПИТРС переносилась неудовлетворительно, в 10,7% случаев — плохо. При этом копаксон переносится достоверно (p<0,01) лучше, чем ИФН (только в 4,5% — неудовлетворительно и 1,5% — плохо). Терапия глатирамера ацетатом крайне редко прерывалась из-за побочных эффектов, даже в случае наличия специфической генерализованной системной реакции, имевшей место у 6,0% пациентов. Это может быть связано с лучшим профилем влияния препарата на психоэмоциональную сферу в виде снижения выраженности астении и утомляемости, отсутствия депрессогенного эффекта [3].
При использовании копаксона
(n=67) у пациентов преобладали местные реакции в виде гиперемии (23,9%) и уплотнения (19,4%) в месте инъекций, реже регистрировались боли (4,5%), липодистрофии (7,5%) и зуд (6,0%) в месте укола. При этом боль и гиперемия в месте инъекций отмечались достоверно (16,5%, p<0,05 и 35,6%, p<0,01 соответственно) реже, чем в группе ИФН, а липодистрофии — достоверно чаще (0,9%, p<0,01).
При использовании низкодозного ИФН β-1a авонекса (n=12) у пациентов имели место преимущественно генерализованные побочные реакции в виде гриппоподобного синдрома (58,3%), при этом их частота достоверно не отличалась от группы ИФН в целом. Умеренных и выраженных местных побочных реакций зарегистрировано не было, что, вероятно, связано с внутримышечным путем введения. Хорошая переносимость авонекса была отмечена у 75% пациентов, что достоверно не отличалось от всей группы ИФН.
При анализе переносимости ИФН β-1а для подкожного введения (рис. 1)
| Рис. 1. Сравнение побочных эффектов ребифа и генфаксона (% пациентов). |
| ]]> |
установлено, что доля пациентов с умеренной и плохой переносимостью ребифа (n=77) составила 24,7% (20,8 и 3,9% соответственно) — достоверно ниже, чем в группе ИФН в целом, а в группе генфаксона (n=34) этот показатель достиг 70,6% (58,8 и 11,8% соответственно) — достоверно выше, чем по всей группе ИФН.
Гриппоподобный синдром встречался у 33,8% пациентов группы ребифа (n=77), что достоверно не отличалось от общей группы ИФН. Среди системных реакций также имели место судороги и слабость в ногах (7,8%), частота этих НПР была такой же, как в целом по группе ИФН. Местные реакции при использовании препарата проявлялись преимущественно гиперемией (35,1%) и уплотнениями (11,7%) в месте инъекций, что достоверно не отличалось от показателей группы в целом. Отдельного внимания заслуживает достоверно (p<0,001) меньшая частота боли в месте инъекции (2,6%) по сравнению с общей группой ИФН, что может быть связано с новой формулой препарата и использованием автоматических устройств для проведения инъекций.
В группе генфаксона (n=34) гриппоподобный синдром отмечался в 61,8%, а судороги и слабость в ногах после инъекции — в 20,8% случаев, что было достоверно выше, чем по группе ИФН в целом (p<0,01 и p<0,05 соответственно). Гиперемия в месте инъекции встречалась в 58,8%, боли — в 47,1% случаев, что было достоверно (p<0,01) чаще, чем в общей группе ИФН. Уплотнения в месте инъекции выявлялись в 23,5%, некрозы — в 2,9% случаев, что не отличалось от выборки в целом.
При сопоставлении частоты НПР для интерферонов β-1а для подкожного введения ребифа и генфаксона выявлено, что гриппоподобный синдром и местные реакции в виде гиперемии и боли в месте инъекции при использовании ребифа не отличались от группы ИФН в целом, а для генфаксона этот показатель был достоверно выше.
В группе ИФН β-1b (рис. 2)
| Рис. 2. Сравнение побочных эффектов бетаферона, экставии и ронбетала (% пациентов). |
| ]]> |
удовлетворительная и плохая переносимость бетаферона (15,2%) и экставии (16,4%) регистрировалась достоверно (p<0,01) реже, чем по группе ИФН в целом. Анализ переносимости ронбетала показал обратную ситуацию, неудовлетворительная переносимость препарата регистрировалась в 81,9% случаев (p<0,01).
При оценке спектра системных побочных реакций выявлены практически идентичные показатели для групп бетаферона и экставии: гриппоподобный синдром встречался у данных пациентов в 18,2 и 24,7% соответственно, что достоверно не отличалось от группы ИФН в целом. Для ронбетала встречаемость синдрома составила 59,7%, что было достоверно выше аналогичных показателей группы в целом (p<0,01). Также в группе ронбетала чаще отмечались генерализованная кожная сыпь (2,8%) и ощущение скованности и тянущих судорог в ногах (13,9%), однако достоверных отличий получено не было.
Местные реакции в виде гиперемии и боли в месте инъекции в группах бетаферона (15,3 и 4,5% соответственно) и экставии (19,2 и 4,1% соответственно) встречались достоверно (p<0,01) реже, чем в группе в целом.
В группе ронбетала достоверно чаще регистрировались гиперемия в месте инъекции — в 66,7% случаев (p<0,01), уплотнения и отек — в 31,9% (p<0,01), зуд — в 8,5% (p<0,05).
Обсуждение
Считается, что оригинальный и воспроизведенные препараты являются идентичными друг другу, имеют одинаковую эффективность и безопасность. Наиболее привлекательны биоаналоги с точки зрения цены, что повышает доступность их применения не только для населения, но и государства. Однако, несмотря на экономические преимущества, биоаналоги редко полностью сопоставимы с оригиналом по эффективности и безопасности вследствие невозможности создания двух абсолютно идентичных банков клеток, служащих для получения активной молекулы, невозможности точного повторения длительного наукоемкого процесса производства. Любое отклонение, особенно нарушение условий культивирования клеток и упрощение процесса очистки, влечет отклонения в структуре конечного продукта и соотношении изоформ, в связи с этим особый риск представляет перевод пациента с одного препарата на другой [2].
Выявленные по данным регистра РС Ярославской области отличия в профиле безопасности отдельных биоаналогов от оригинальных ПИТРС (рис. 3)
| Рис. 3. Сравнение переносимости препаратов по данным опроса пациентов. |
| ]]> |
заставляют еще раз обратить внимание на необходимость подробного изучения эффектов препаратов в рамках клинических и постмаркетинговых исследований, в том числе ведения регистров больных, получающих тот или иной ПИТРС. Проведение подобных исследований особенно значимо в силу отсутствия достаточных убедительных данных о сравнительной эффективности биоаналогов и оригинальных препаратов.
В последнее время ВОЗ рассматривает возможности введения индивидуальных международных непатентованных названий для каждого из биоаналогов, обязательного назначения биоаналогов под торговым наименованием или (в отсутствие такового) — с указанием названия фирмы-производителя [2]. Данные меры абсолютно необходимы для обеспечения мониторинга иммуногенности, безопасности и эффективности биоаналогов ПИТРС после регистрации их на фармацевтическом рынке.
Механизм действия
Несмотря на общую направленность, механизмы действия различных препаратов отличаются:
- Интерфероны бета имеют общее, неспецифическое иммуномодулирующее действие.
- Глатирамера ацетату присуще специфическое влияние: конкурентное замещение антигенов миелина в местах соединения с молекулами основного комплекса гистосовместимости. Результатом действия препарата является торможение Т1-лимфоцитов и активация Т2-лимфоцитов, последние имеют позитивное влияние на ход заболевания и способствуют противовоспалительным и нейропротекторным процессам.
- Терифлуномид тормозит деление клеток иммунной системы, приводит к уменьшению числа циркулирующих В- и Т-клеток. Препарату присущи иммуномодулирующее и противовоспалительное свойства.
- Натализумаб является рекомбинантным моноклональным антителом к молекулам адгезии. Действие направлено на замедление попадания лимфоцитов через гематоэнцефалический барьер, подавление активности Т-лимфоцитов в очагах повреждения аксонов и снижение вероятности возвратного воспаления в поврежденных местах.
- Действие Финголимода основано на инновации: блокировка сфингозин-фосфатных рецепторов лимфоцитов, вследствие чего лимфоциты не покидают лимфоузлы и соответственно уменьшается количество аутоагрессивных Т-клеток в крови, также препарат проникает в головной мозг и влияет на сфингозин-1-фосфатные рецепторы глиальных клеток и нейронов.
- Митоксантрон создает связи с ядерной ДНК. Механизм его действия до конца не изучен. Известно, что препарат имеет цитотоксический эффект как на пролиферирующие, так и на непролиферирующие клетки человека, то есть его действие не связано с фазой клеточного цикла
Трансплантация стволовых клеток (ТСК)
Дорогостоящая и достаточно эффективная на сегодняшний день технология. Суть операции заключается в заборе образца костного мозга, после которого пациенту назначается курс химиотерапии. Активность иммунной системы снижается, и после этого больному возвращают ранее забранные его же стволовые клетки. В течение 1-2 месяцев иммунитет больного начинает полноценно функционировать, значительно замедляя процесс повреждения миелина.
Стволовые клетки регенерируют клетки белого вещества, устраняют рубцы на поражённых участках, восстанавливают функции нервных окончаний. Помимо этого, стволовые клетки положительно влияют на иммунную систему организма. Учёные считают, что этот метод в дальнейшем поможет победить рассеянный склероз. Эффективность методики составляет 50/50%.
ПИТРС первой и второй линии
Как правило, лечение рассеянного склероза начинают с ПИТРС первой линии:
В начальной стадии лечения применяют:
- интерферон-бета-1а – подкожно (три раза в неделю);
- интерферон-бета-1а – применяют внутримышечно (1 раз в неделю);
- интерферон-бета-1б – подкожно (через день);
- глатирамера ацетат – подкожно (каждый день);
- терифлунамид в таблетках (каждый день).
Действие препаратов первой линии изучено лучше второй. Эффективность их высокая, но в некоторых случаях недостаточная, что дает врачу основания для назначения ПИТРС второй линии:
- Натализумаб – внутривенно капельно (один раз в 4 недели);
- Финголимод – в таблетках (ежедневно).
Для лечения пациентов с высокой активностью рецидивирующего рассеянного склероза, сопровождаемого быстрой потерей трудоспособности, при невозможности применения альтернативных терапевтических средств, применяют антинеопластические препараты (например, Митоксантрон — внутривенно капельно один раз в три месяца).
Основным побочным эффектом ПИТРС первой линии являются нарушения психики, проявляемые депрессивными состояниями. Также возможно негативное влияние препаратов на кровеносную, гепатобилиарную, центральную нервную системы.
Для медикаментов второй линии характерными являются несколько тяжелых побочных последствий – поражение сердечной мышцы, нарушения ритма работы сердца, появление прогрессирующей многоочаговой лейкодистрофии.
При выборе препаратов второй линии врач прибегает к тщательному анализу возможных рисков вследствие их назначения. Пациенту рекомендуется находиться по регулярным медицинским наблюдением.
Протокол Коимбра
Протокол Коимбра – высокоэффективный метод, позволяющий добиться длительной устойчивой ремиссии больного. Пациенту назначается высокая доза витамина Д, при этом из рациона исключаются продукты, содержащие кальций (творог, молоко и т.п.). Устанавливается норма употребления воды – не менее 2,5 л. Этого объёма достаточно, чтобы растворить и вывести соли кальция из организма. Видимый эффект от лечения наступает через два месяца, а через год состояние пациента переходит в стадию устойчивой ремиссии. Для сохранения двигательных функций пациенту необходимо систематически выполнять физические упражнения.
Стоимость лечения по протоколу Коимбра невысока, проводить его нужно только под наблюдением врача. Значительное улучшение состояния пациента достигается в 95% случаев. Во многом результат лечения зависит от стадии заболевания, при которой оно было начато. На 1-2 стадии отмечаются значительные улучшения, но если начать лечение в более поздний срок, вероятность остановить прогрессирование рассеянного склероза достаточно высокая.
Лечебный эффект, показания
Задача терапии ПИТРС вызвать в организме больного такие изменения:
- сократить, выявленные при МРТ очаги повреждений центральной нервной системы (головной и спинной мозг);
- снизить количество обострений;
- облегчить течение болезни;
- сохранить работоспособность и способность к самообслуживанию;
- отдалить инвалидизацию;
Препараты первой линии назначают при наличии таких симптомов:
- ремитирующий тип рассеянного склероза;
- возрастной критерий: 18 — 50 лет;
- тяжесть клинической картины не превышает 5,5 баллов по шкале EDSS;
- на протяжении предшествующих двух лет минимум 2 обострения с разрывом 30 дней и больше между ними и стабильным неврологическим состоянием.
Показания для назначения ПИТРС 2 линии:
- первично агрессивное течение рассеянного склероза;
- недостаточная эффективность препаратов первого ряда.
В случае беспрестанного ухудшения аутоиммунных процессов на фоне специфического лечения в качестве препаратов третьей линии могут применять антинеопластические средства (циклофосфамид и митоксантрон).
В крайних случаях прибегают к аутотрансплантации костного мозга.
Лечение при обострении
Обострение рассеянного склероза происходит при новом повреждении клеток спинного или головного мозга. При этом нарушается передача нервных сигналов, что может вызвать новые симптомы или обострить старые. Фаза обострения может длиться от суток до месяца. Рецидивы отличаются как по характеру, так и по тяжести протекания.
Приступы могут повторяться с различной интенсивностью. В зависимости от симптоматики врач может назначить пульс-терапию кортикостероидов – больших доз гормонов, вводимых внутривенно, которые ускорят восстановление. Как правило, это метилпреднизолон или его аналоги. Для уменьшения побочного эффекта назначают препараты калия, диету с высоким содержанием солей калия (яблоки, изюм, бананы), средства для защиты слизистой оболочки желудка (Альмагель, Фосфалюгель и т.п.), а также курс антибиотиков для исключения возможной инфекции.
Эффективно применение капельниц иммуноглобулина человеческого (Сандоглобулин, Пентаглобулин). Курс лечения составляет 5 дней.
При невозможности проведения пульс-терапии назначается лечение Дексаметазоном (внутривенно или внутримышечно), с постепенным уменьшением дозировки.
При тяжёлых обострениях врач может назначить плазмаферез – процедуру очистки плазмы крови от антител. Плазмаферез практикуется с 80-х годов прошлого века и показывает хорошие результаты. Лечение занимает около 2-х недель, в течение которых проводится 3-5 процедур фильтрации крови через специальную систему. Кровь больного при помощи специального аппарата разделяется на плазму и красную кровь (эрмассу). Плазма с вредными веществами удаляется из организма, а эрмасса возвращается больному в организм через другую вену. Вместо плазмы могут вводить альбумин, донорскую плазму или её заменители (гемодез, реополиглюкин и т.п.). В некоторых случаях могут сочетаться пульс-терапия и плазмаферез.
При нарастающем прогрессе рассеянного склероза и при неэффективности гормонов назначают курс цитостатиков (Азатиоприна, Циклофосфамида и т.п.), которые способствуют подавлению аутоиммунного процесса. Однако у этих препаратов из-за высокой токсичности есть ряд побочных эффектов: резкое снижение лейкоцитов, эритроцитов и тромбоцитов, и, как следствие – развивается лекарственный гепатит, начинается выпадение волос, могут быть частая рвота, диарея или тошнота.
Когда медикаменты не используют
Общими для всех ПИТРС являются такие противопоказания:
- гиперчувствительность к действующему веществу или вспомогательным составляющим препарата;
- декомпенсированные или тяжелые формы заболеваний печени;
- беременность, вскармливание грудным молоком.
Дополнительные противопоказания для интерферонов:
- первично прогрессирующие формы РС;
- наличие тяжелых депрессий, мыслей о суициде, психические расстройства;
- сердечные заболевания в тяжелых формах.
Дополнительные противопоказания для глатирамера ацетата:
- панические атаки.
Дополнительные противопоказания для терифлунамида:
- иммунодефицитные состояния тяжелой формы;
- патологии кроветворения;
- декомпенсация почек;
- острые инфекционные заболевания в тяжелых формах;
- резкое снижения белка в крови;
- возраст до 18 лет.
Характерные дополнительные противопоказания для ПИТРС второй линии:
- иммунодефицитные состояния;
- возможность инфицирования пациента условно-патогенными микроорганизмами;
- раковые опухоли, кроме базалиомы;
- прогрессирующая многоочаговая лейкоэнцефалопатия;
- одновременное применение ПИТРС первой линии;
- детский и подростковый возраст.
Следует знать, что назначение ПИТРС детям до 12 лет должно быть одобрено врачебной комиссией, при выборе препаратов обязательно учитываются результаты диагностических исследований. Родителей/законных представителей уведомляют о возможных рисках и берут согласие на назначение медикаментов ребенку.
Диета при рассеянном склерозе
В различных источниках можно найти огромное количество статей и рекомендаций по питанию при рассеянном склерозе. В некоторых из них настоятельно рекомендуется придерживаться специальных диет. Некоторые специалисты утверждают, что при помощи диеты можно полностью излечиться. Однако это не совсем так, хотя исключить употребление некоторых продуктов всё-таки стоит. В первую очередь это касается продуктов животного происхождения с высоким содержанием холестерина:
- жирная свинина;
- жирные сорта рыбы;
- колбасы;
- субпродукты;
- сыры с высоким % жирности;
- взбитые сливки;
- арахисовое и сливочное масло;
- яйца;
- гусиный жир;
- икра;
- шоколад;
- какао.
Повышенный холестерин плохо влияет на проходимость сосудов, а значит, при РС усугубляет проблемы с координацией движений и снижает как физическую, так и умственную активность.
При рассеянном склерозе в первую очередь важно придерживаться сбалансированного питания по соотношению количества белков, жиров и углеводов. В пищу нужно употреблять большое количество свежих овощей и фруктов, продуктов с высоким содержанием микроэлементов и витаминов. Это способствует ускоренному метаболизму.
Не менее полезными будут продукты с высоким содержанием линолевой кислоты – орехи и растительное масло, блюда и продукты из цельнозерновых круп. Для улучшения работы кишечника и пища должна быть с высоким содержанием клетчатки и растительных волокон.
Кето диета. Это низкоуглеводная диета, при которой из рациона исключаются продукты с высоким содержанием т.н. быстрых углеводов: сахар, конфеты, мучные блюда, выпечка, картофель, макароны и т.п. Зафиксированы единичные случаи эффективности кето диеты при рассеянном склерозе. В частности описан случай с восстановлением двигательной активности пациента при соблюдении Палео диеты – одной из разновидностей Кето диеты.
Диета Эштона Эмбри. Это специальная разработка канадского учёного, которая не имеет фундаментальных подтверждений, но собрала большое количество положительных отзывов.
В основе диеты лежит исключение из рациона продуктов, которые могут спровоцировать разрушение иммунной системой собственных тканей организма. В рацион включается большое количество веществ, которые благоприятно влияют на нервную систему и не дают развиваться болезни. Основной принцип – принимать большое количество витаминов и минералов и исключать продукты, которые могут вызвать обострение. Из рациона исключаются:
- молочные продукты;
- все виды красного мяса;
- злаки, содержащие глютен;
- бобы;
- пиво и пивные дрожжи;
- бобы;
- желтки куриных яиц;
- сладости, включая мёд;
- крепкий чай и кофе;
- напитки и алкоголь с содержанием сахара;
- изделия с содержанием пальмового или кокосового масла;
- фастфуд.
Рекомендовано включать морскую рыбу, крупы без глютена, орехи, овощи, а также специальные витаминные комплексы.
В любом случае, если внимательно относиться к питанию, вреда для организма не будет. Исключение из рациона продуктов, которые могут нанести вред организму, в интересах больного.
Практический опыт применения
По результатам одного из научных исследований «Оценка пациентами эффективности терапии рассеянного склероза», результаты которого опубликованы в 2021 году, главными показателями эффективности лечения являются отсутствие обостренной клинической картины и прогрессирования нарушений со стороны нервной системы.
При этом субъективное мнение пациентов об эффективности лечения встречалось чаще, чем эффективность была подтверждена диагностическими методами. За три года исследуемые пациенты отмечают в 57% случаев снижение количества обострений от 1 до 3 и в 24% случаев отсутствие обостренной клинической картины. Все эти люди считают терапию эффективной.
В ходе исследования установлен порог низкой эффективности лечения: больше трех эпизодов обострения клинической картины за три года.
Исследованием также установлено, что субъективные оценки положительного эффекта от лечения РС напрямую зависят от взаимоотношений, сложившихся с лечащим врачом. Пациенты, которые указали на совпадение своего видения эффекта от лечения с целями, поставленными лечащим врачом, в основном поставили высокую оценку результатам терапии. Неэффективным лечение чаще признавали те пациенты, у которых мнение расходилось с целями врачей.
Разрешенные ПИТРС в России
Симптоматическое лечение
Этот вид лечения является дополнением к основным назначениям при обострении рассеянного склероза. Терапия назначается в соответствии с клиническими проявлениями в зависимости от конкретных симптомов.
В фазе обострения больные часто жалуются на спастичность, которая проявляется в тугоподвижности поражённых конечностей или частей туловища, и рефлекторные спазмы. Они затрудняют возможность передвижения больного и являются причиной усталости и малоподвижности. Часто наблюдаются нарушения сна или болезненные ощущения всего тела.
Для дальнейшего сохранения функций мышечных тканей важно продолжать заниматься лечебной физкультурой. Дополнительно врач может назначить физиопроцедуры (электрофорез, УВЧ-терапию или УФО), помогающие снизить воспаление суставов и интоксикацию организма, улучшить обменные процессы, скорректировать двигательные расстройства.
Существуют общие положения, согласно которых врач назначает лечение:
- синтетические интерфероны (β- интерферон);
- глюкокортикоиды. Преднизолон, дексаметазон, метипред или гормональный препарат АКТГ;
- витамины группы В, биостимуляторы, мелинообразующие препараты (биосинакс, кронассиал);
- цитостатики в качестве дополнения: циклофосфан, азатиоприн;
- для снятия мышечного тонуса применяют миорелаксанты (мидокалм, лиорезал, милликтин).