Прионные болезни – трансмиссивные спонгиоформные энцефалопатии (ТСЭ) – это относительно новая группа дегенеративных заболеваний ЦНС. Расстройства характеризуются хроническим необычным взаимодействием иммунной системы и предполагаемого этиологического фактора – белка приона. Он на периферическом пути болезни размножается в эндоретулярной системе, откуда переходит в ЦНС (головной и спинной мозг), где он вызывают васкуляризацию нейроцитов, глиальных клеток, спонгиоматозную реконструкцию нейропилуса, вымирание и уменьшение количества нейрональных клеток, глиоз без значительного вовлечения воспаления.
«Био/мол/текст»-2012
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2012 в номинации «Лучшее новостное сообщение».
Спонсор конкурса — дальновидная компания Thermo Fisher Scientific.
Всё началось с того, что в 20 веке учёные заинтересовались природой необычных заболеваний человека и животных: куру, Крейтцфельда-Якоба, скрэпи. Заметное сходство патологии этих болезней дало основание для гипотезы об их инфекционности, что впоследствии было экспериментально подтверждено. Тогда возник вопрос о возбудителе данных заболеваний. Прежде чем был найден ответ, были выявлены необычайные свойства возбудителей: они не размножаются на искусственных питательных средах, устойчивы к высокой температуре, формальдегиду, различным видам излучений, действию нуклеаз. Очистка инфекционного материала и его изучение позволило провозгласить о том, что «во всём виноват» белок, который 30 лет назад получил название прион (от англ. prion — белковая инфекция).
Так, известные американские учёные — вирусолог и врач Д.К. Гайдушек, раскрывший инфекционную природу прионных болезней, в 1976 г. и биохимик С.Б. Прузинер, который определил прионы и разработал прионную теорию, в 1997 г., — были удостоены Нобелевских премий. Их работы стали импульсом для последующих исследований, благодаря которым были изучены новые виды прионных инфекций. Но, даже несмотря на неугасающий интерес к «прионной теме», образование прионов до сегодняшнего дня остаётся загадкой.
Как замедлить течение прионной болезни
До недавнего времени было сложно замедлить прионную болезнь, не говоря о ее излечении.
Современная нейрохирургия может облегчить дегенеративные осложнения путем пересадки нейронов при прионом заболевании.
Революционная попытка остановить патогенные протеины была впервые предпринята командой врачей из Университета Питтсбурга. Команда д-ра Кондзиолки в рамках исследования пересадила 12 пациентам нейроны in vitro (2-6 млн. LBS-нейронов). Через 12 месяцев после операции ни у одного из реципиентов не было зарегистрировано нежелательных последствий трансплантации, у всех новые клетки были приняты. У 6 пациентов произошло значительное улучшение состояния.
Несколько лет журнал «Nature» сообщил о разработке антител против прионов в Англии командой ученых во главе с Симоной Хоук (Imperial College). В тестах на зараженных мышах, грызуны, получившие антитела, были вылечены уже через месяц после заражения.
Врачи намерены использовать эту возможность очистить нейроны от патогенных протеинов для лечения нового варианта болезни Крейтцфельда-Якобса у людей. Дальнейшие исследования должны помочь улучшить лекарства, которые смогут очистить мозг и его микроглии от прионов.
Недавно М. Пфайфер и несколько других немецких ученых обнаружили и подтвердили способ, позволяющий очистить мозг от прионов. Они доказали, что РНК-интерференция может успешно лечить заболевания путем удаления из РНК-клетки части, ответственной за выработку патогенных белков. Это предотвратило их мутацию в опасные протеины.
Подобный метод – воздействие искусственно синтезируемых праймеров (олигонуклеотидов) против прионов. Как и РНК-интерференция, конструирование праймеров находится на стадии исследования.
Теоретически перспективным в лечении болезней может быть пептид PrP13, аналогичный структурному продукту, встречающемуся при этих заболеваниях. Вещество нацелено на ген PRNP, что должно повлиять на превращение PrPC в PrPres. Последняя названная патогенная молекула изменяется в структуру, подобную PrPC. Вещество используется под аббревиатурой PrP13, а его исследования на животных смогли продлить выживаемость на 50-300%.
Биологическая сущность прионов
Рисунок 1. Метафора нейродегенеративного поражения мозга — это губка, в которую превращается нервная ткань в результате массовой гибели нейронов.
Молекула приона не является чем-то экзотическим: в «нормальной» форме она имеется на поверхности нервных у каждого из нас. При этом мы отлично себя чувствуем, и наши нервные клетки живы и здоровы. Однако это всё до тех пор, пока наш нормальный белок не «переродится» в аномальную форму. А если это случится, то приведёт к ужасающим последствиям: инфекционная форма прионов имеет свойство «склеиваться» с другими молекулами и, мало того, «конвертировать» их в эту же самую форму, вызывая «молекулярную эпидемию». В результате этой полимеризации на нервной клетке появляются токсичные белковые бляшки , и она погибает [1]. На месте погибшей клетки образуется пустота — вакуоль, заполненная жидкостью. С течением времени будет исчезать один нейрон за другим, а в мозге — образовываться всё больше «дыр», пока, наконец, мозг не превратится в губку (рис. 1), за чем неминуемо последует смерть.
Существует упрощенное представление, что полимеризованные прионные фибриллы «протыкают» нейрон, что вызывает его гибель. На самом деле это не совсем так: предшествующие фибриллярной стадии сферические агрегаты прионов также обладают токсичностью (по крайней мере, для болезни Альцгеймера): «Альцгеймеровский нейротоксин: ядовиты не только фибриллы». — Ред.
Но как может нормальный природный белок (обозначается PrPC) вдруг стать патологическим (PrPSc; Sc — от слова «scrapie»)? Что должно произойти? Как и в случае «обычной» инфекции, для такой трансформации необходима встреча с молекулой инфекционного приона. Существуют два пути передачи этой молекулы: наследственный (за счёт мутаций в гене, кодирующего белок) и инфекционный. То есть внедрение приона может произойти неожиданно — например, при употреблении в пищу недостаточно хорошо прожаренного или сваренного мяса (в котором должна присутствовать форма PrPSc), при переливании крови, при трансплантации органов и тканей, при введении гормонов гипофиза животного происхождения.
И тогда происходит удивительное событие: нормальные молекулы белка, контактируя с патологическими, сами превращаются в них, изменяя свою пространственную структуру (механизм трансформации остаётся загадкой и по сей день) [1]. Таким образом прион, как самый настоящий инфекционный агент, заражает нормальные молекулы, запуская цепную реакцию, разрушительную для клетки.
Отдельные нозологические единицы
Прионные болезни человека видоспецифичные. В основном они распространяются только среди особей одного вида. Но учеными была продемонстрирована межвидовая передача (преодоление межвидового барьера): это произошло у скрепи овец с ее передачей коровам (коровье бешенство). Передача заболевания от животного к человеку, несмотря на многие подозрения, не была продемонстрирована.
Ряд заболеваний имеет наследственное происхождение, часть является инфекционной. Иногда болезнь возникает неожиданно, без возможности профилактики.
Куру
Болезнь существовала только в Папуа-Новой Гвинее в племенах людоедов, потреблявших мозги мертвых. Она проявляется тремором («куру» означает «тремор»), нарушениями речи, равновесия (атаксия). Через несколько месяцев наступает смерть. После остановки каннибализма, заболевание куру исчезло.
Болезнь Крейцфельдта-Якоба (Creutzfeldt-Jakob disease)
Это редкое расстройство, поражающее пожилых людей (чаще всего 50-70-летних). Его течение относительно быстрое, смерть наступает через несколько месяцев (до года) от проявления первых симптомов. Нейроны быстро гибнут, развивается прогрессивная деменция, не имеющая известного лечения. Существует некоторая наследственная предрасположенность к этому заболеванию:
- Спорадическая форма. Заболеваемость составляет 1-2/1000000. Проблемы начинаются примерно в возрасте 65 лет. Расстройство возникает в виде острого прогрессирования деменции (в течение 2-3 месяцев), атаксии, миоклонуса. Возможностей, как продлить жизнь нейронам при этом прионом заболевании, нет, пациент умирает через 5-12 месяцев после появления первых симптомов.
- Ятрогенная форма. Возникала у пациентов, получавших гормон роста человека из трупных гипофизов (сегодня он готовится рекомбинантно), пересадкой твердых оболочек, перикарда, роговицы. Существует риск нейрохирургической передачи. Заражение возможно также при переливании.
- Семейная форма. Это генетическая форма с мутацией в гене PRNP и психоневрологической симптоматикой.
- Новый вариант. Характеризуется психиатрическими симптомами (тревога, депрессия, изменения в поведении), прогрессирующим мозжечковым синдромом, миоклонусом, другими неврологическими симптомами. В отличие от спорадической формы, новый вариант типичен медленным развитием вирусной инфекции; прионная болезнь затрагивает более молодые возрастные группы. Передача происходит алиментарным путем (при потреблении мяса пораженных животных). Инкубационный период – более 10 лет. В мире на сегодняшний день погибло около 200 человек.
- Детский вариант болезни Крейцфельдта-Якоба – болезнь Альпера. Имеет те же проявления, что и заболевание у взрослых; в дополнение сопровождается стеатозом печени.
Болезнь Герстманна-Штрюсслера-Шейнкера (Gerstmann-Sträussler-Scheinker disease)
Болезнь Герстманна-Штрюсслера-Шейнкера – это очень редкое аутосомно-доминантное наследственное заболевание, начинающееся в 3-4-ой декаде жизни. Проявляется медленным замедлением работы нейронов прионами, прогрессирующей дисфункцией мозжечка и спинного мозга. Признаки:
- атаксия;
- пирамидные симптомы;
- дизартрия;
- дисфагия;
- постепенно развивающаяся деменция.
В начале расстройства могут возникнуть апатия, депрессия. Средняя продолжительность заболевания – около 4-5 лет. Было описано несколько мутаций PRNP, связанных с этим расстройством.
Фатальная фамильярная инсомния (Fatal familiar insomnia)
Это очень редкое заболевание, приводящее к дегенерации ядра таламуса. Основные симптомы:
- прогрессирующая бессонница;
- вегетативная и эндокринная дисфункция;
- дизартрия;
- атаксия;
- миоклонус;
- пирамидные симптомы.
Дистрофия мозга по воздействием вируса приона
Развиваются когнитивные нарушения, появляются спутанность сознания и галлюцинации. В терминальной стадии развивается полная инсомния. Пациенты умирают в течение 3 лет от проявления первых признаков. Заболевание связано с мутацией PRNP D178N-129M. Существует также спорадическая форма расстройства.
Некоторые сведения о прионах
Исследователи отмечают:
- прионный белок включает 254 аминокислотных остатка и «весит» 33–35 килодальтон [2];
- ген, кодирующий белок PrP, найден у человека, млекопитающих и птиц [1];
- для полного уничтожения прионного белка нужна температура не менее 1000 градусов [1]!
- возможно, прионы принимают участие в межклеточном узнавании и клеточной активации [3];
- не исключено, что функцией прионов является подавление возрастных процессов [3];
- при развитии клинических проявлений прионных заболеваний нет ни признаков воспаления, ни изменений в крови;
- предполагается, что прионы участвуют в развитии шизофрении и миопатии;
- механизм действия прионов и их превращения из нормальной формы в патологическую остаётся неясным.
Характеристика инфекций
Заболевания вызываются возбудителями, не содержащими нуклеиновой кислоты. Они могут быть спорадическими, генетически обусловленными, инфекционными (даже ятрогенными). Присутствие дефектных белков вызывает расстройства, обычно называемые спонгиоформными энцефалопатиями. Это дегенеративные нарушения нервной системы, при которых мозг постепенно приобретает губчатый вид из-за миниатюрных отверстий, ввиду того, что прионы убивают нейроны.
Все инфекции неизлечимы и смертельны. Сегодня проводятся исследования и тестирования, направленные на изучение методов замедления течения прионной болезни.
Условия возникновения заболеваний
Условия возникновения прионовых болезней уникальны. Они могут формироваться по трём сценариям: как инфекционные, спорадические и наследственные поражения. В последнем варианте главную роль играет генетическая предрасположенность [2].
Знаменитый исследователь прионов Стэнли Прузинер (Stanley Prusiner) выделяет две поразительные особенности, присущие таким нейродегенеративным заболеваниям, как болезнь Крейтцфельда-Якоба, болезнь Альцгеймера и болезнь Паркинсона. Первая заключается в том, что более 80% случаев заболевания — спорадические (то есть, случайные, возникающие «сами собой»). Вторая: несмотря на то, что большое количество мутантных белков, специфичных к определённой болезни, экспрессируется в процессе зародышевого развития, формы наследования этих нейродегенеративных заболеваний проявляются позже. Это предполагает, что некоторые процессы происходят во время старения, которое «дает волю» болезнетворным белкам [5]. Более 20 лет назад автор утверждал, что данный процесс включает случайный рефолдинг (пересворачивание) белка в неправильно свёрнутый, что соответствует переходу в инфекционное состояние — прион.
Интересные факты насчет болезни Альцгеймера: ее вероятность может повышаться вследствие хронического недосыпания («Новый шаг к пониманию болезни Альцгеймера: возможно, недосыпание является одним из факторов риска»), а сам альцгеймеровский нейропептид (β-амилоид Aβ) может быть частью системы врожденного иммунитета («Возможно, β-амилоид болезни Альцгеймера — часть врождённого иммунитета»). — Ред.
В последнее десятилетие интерес к этой теме возобновился в связи с возможностью развития диагностики и эффективной терапии [5]. Появилось множество различных объяснений для возрастных нейродегенеративных болезней, — например, окислительная модификация ДНК, липидов и/или белков; соматические мутации; измененный врождённый иммунитет; экзогенные токсины; несоответствия ДНК—РНК; нарушение работы шаперонов; отсутствие одного из аллелей гена [5]. Альтернативным комплексным разъяснением служит то, что различные группы белков могут формировать прионы. Несмотря на то, что небольшое количество прионов может быть удалено посредством путей белковой деградации, их чрезмерное накопление с течением времени позволяет прионам самостоятельно распространяться в организме (рис. 2), что приводит к нарушению деятельности центральной нервной системы [5].
Рисунок 2. Процессы нейродегенерации, вызванной прионами. Сверху: накопление «нормального» прионного белка повышает его вероятность перехода в токсичную конформацию, которая описывается бóльшим содержанием β-структуры. Прионы наиболее патогенны в форме олигомеров; после образования фибрилл токсичность снижается. В зависимости от того, о каком конкретно прионном белке идет речь, в патологическом состоянии он может образовывать бляшки, клубки или тельца включения. Возможные пути лекарственного вмешательства: (I) снижение кон белка-предшественника; (II) ингибирование образования прионной формы; (III) уничтожение токсичных агрегатов. Снизу: Наследственная старческая нейродегенерация объясняется двумя событиями: наличием мутантной формы предшественника и образованием из него приона, готового к олиго- и полимеризации с образованием токсичных форм.
[5]
Прион — убийца нейрона
Прион, также известный в микробиологии как инфекционный PrP Sc , – это профессиональный термин, описывающий дефектную форму протеина, часто встречающегося в тканях мозга млекопитающих, способствующего долгосрочному функционированию памяти.
Прионы убивают нейроны очень быстро, что провоцирует стремительное развитие дегенеративных заболеваний.
Согласно теории, речь идет об источнике многих нарушений ЦНС животных (включая человека). Эти белки играют роль в наследственных изменениях и эволюции.
Один из регуляторных факторов прионопреобразования – шапероны, функция которых заключается в чистке клеток от патогенных белков. Как шапероны, так и прионы относятся к группе клеточных протеинов.
Теории и гипотезы
Теория, объясняющая, почему прионы убивают нейроны, была сформулирована профессором С. Б. Прусинером в 1982 г. Он также впервые использовал слово «прион» (первоначально предназначалось использование обозначения «проин», как сочетания слов «proteinaceous» и «infectious», но в измененном состоянии оно звучало лучше).
Теорию прионов, как патогенных белков, Прусинер сформулировал в связи с поиском возбудителя расстройства Крейтцфельда-Якоба. Обнаруженный ним агент являлся чем-то новым. До 1982 г. считалось, что инфекционные заболевания могут вызывать только инфекционные организмы, содержащие нуклеиновую кислоту, несущую генетическую информацию. Но строение белка не содержит нуклеиновой кислоты. Это белок, размножающийся, изменяя аналогичные белки в организме. В 1997 г. С. Б. Прусинер получил Нобелевскую премию в этой области.
Патогенные белки прионы имеют одинаковую первичную структуру (аминокислотную последовательность), но различаются по своей конформационной конфигурации. В то время как дикий PrP с имеет выраженное преобладание α-геликса и около 5% β-листа, патогенный PrP Sc (Sc – scrapie) имеет долю β-листа до 40%. Причины аберрантных свойств прионов PrP Sc все еще рассматриваются. Сегодня есть несколько гипотез.
- Вирусная гипотеза объясняет воздействие прионов вирусологией. Предполагается участие РНК-вирусов в трансмиссивных губчатых энцефалопатиях. Как вироиды, так и прионы – мелкие инфекционные патогены; следовательно, результат воздействия вируса – прион инфекционной природы.
- Мультикомпонентная гипотеза. Предполагается, что для образования инфекционных белков, как новых возбудителей болезней необходима связь с полианионами и липидами.
- Отравление тяжелыми металлами. Интоксикация вызывает развитие инфекции при недостатке или избытке в организме меди (для здорового протеина необходимо оптимальное количество меди).
В чем заключается токсичность белка для нейрона?
После появления инфекционного протеина он может «запечатлеть» свою конформацию в здоровые нейроны. Токсические протеины могут убивать митохондрии в нейронах, распространяя болезнь на ткани.
Патогенные белки чрезвычайно устойчивы к физическим и химическим воздействиям, что приводит к трудностям при стерилизации (были предприняты попытки сжигания головного мозга у пораженных животных при 600°C, пеплом впоследствии были заражены примерно 1/3 животных). В соответствии с тем, какие метаболические процессы нарушают прионы в нейроне, наиболее инфекционные – ткани глаза, головного и спинного мозга.
Лабораторная диагностика и лечение
Диагностика базируется на внутримозговом заражении мышат или хомяков, у которых медленно (до 150 дней) развивается соответствующее заболевание, если пациент был болен [2]. Часто проводится гистологическое исследование головного мозга погибших животных [2].
К сожалению, до настоящего времени еще не разработаны эффективные методы лечения прионовых болезней, хотя попытки предотвратить конформационный переход нормального белка в аномальный производятся. Поэтому самым надёжным способом предупреждения развития инфекционных форм является профилактика [2].
Особенно актуальным становится решение «прионного вопроса» в связи с нарастающей угрозой возникновения эпидемии через инвазивные медицинские операции и даже при приёме лекарственных средств.
Заболевания животных
Риск заболеваний животных для людей очень спекулятивен (лучше всего проблематику характеризует связь BSE и нового варианта расстройства Крейцфельдта-Якобса). У животных расстройства проявляются агрессивностью, нарушением двигательных способностей:
- cпонгиоформная энцефалопатия крупного рогатого скота (Bovine spongiform encephalopathy – BSE);
- скрепи;
- хроническая болезнь истощения (Chronic wasting disease – CWD);
- войлочная спонгиоформная энцефалопатия;
- трансмиссивная энцефалопатия.
Перспективы
По-видимому, интерес к прионам не угаснет до тех пор, пока предположения на их счёт полностью не подтвердятся и не будут найдены эффективные способы лечения прионных заболеваний. В статье [6] говорится о необходимости современного исследования, которое требует тщательного рассмотрения чужеродных прионов в экстраневрональных тканях.
В качестве модельных объектов авторы использовали мышей: две линии, которые трансгенно экспрессировали овечий прионный белок, и одну линию, которая экспрессировала человеческий прионный белок (рис. 3). Задачей было сравнить эффективность межвидовой передачи инфекции посредством тканей мозга и селезёнки. Внутримозговое заражение чужеродным прионным белком выражалось в отсутствии или небольшом количестве инфекционного агента в мозгах этих мышей. Однако инфекционные чужеродные прионы обнаруживались в селезёнке на более ранних этапах заражения в сравнении с моментом, когда были использованы нейротропные прионы, тем самым определяя, что лимфатическая ткань может быть более пермиссивной к распространению чужеродных прионов по сравнению с мозгом.
Рисунок 3. Способность приона хомяков Sc237 заражать и передаваться при введении в мозг или селезенку трансгенным мышам, имеющим прионный белок PrP овцы (tg338; белые мыши) или человека (tg7; серые мыши). Число заболевших/инъецированных мышей показано в скобках; ниже приведено среднее время жизни (в днях).
[6]
Чем вызвана эта предпочтительная репликация прионов в лимфатических тканях, пока неизвестно. Однако полученные данные показывают, что человек может быть более чувствительным к чужеродным прионам, чем предполагалось ранее на основании присутствия прионов в мозгу, и по этой причине бессимптомный переносчик прионной болезни может быть не распознан. Это ещё раз подтверждает, что такая могущественная биомолекула как прион таит в себе немало загадок, раскрытие которых, возможно, поможет в понимании ряда неразрешимых проблем человечества…
Диагностика
Диагностика прионных болезней основана на обнаружении когнитивных расстройств, их прогрессирующем развитии, и уже на промежуточной стадии развития – не специфических нарушений ЭЭГ, постепенно переходящих на специфические паттерны (burst suppression pattern) с миоклониями в клинической и ЭМГ картине, эпилептическими приступами.
В спинномозговой жидкости присутствует только белок 14-3-3.
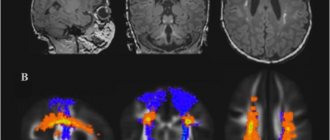
При спорадической форме болезни Крейцфельдта-Якобса МРТ на взвешенном изображении Т2 демонстрирует гиперинтенсивность в базальном и хвостовом ядре. При новом варианте заболевания она присутствует в пульвинарном таламусе, имеет форму клюшки.
Тестирование ДНК поможет выявить генетические и семейные формы расстройств, что означает выявление мутации E200K.
Подтверждением клинико-диагностического заключения являются иммуногистохимическое и нейрогистологическое исследование ткани головного мозга.
Демонстрируется:
- типичная нейроцитарная вакуолизация;
- спонгиоматозная дегенерация нейропилы;
- потеря нервных клеток;
- астроглиоз;
- наличия скрепи-ассоциированных фибрилл в пораженном мозге.
Литература
- Абрамова З.И. Исследование белков и нуклеиновых кислот. Казань: Казанский государственный университет, 2006. — 157 с.;
- Новиков Д.К., Генералов И.И., Данющенкова Н.М. Медицинская микробиология. Витебск: ВГУ, 2010. — 597 с.;
- Прудникова С.В. Микробиология с основами вирусологии. Красноярск: ИПК СФУ, 2008;
- Поздеев О.К., Покровский В.И. Медицинская микробиология. М.: Гэотар-мед, 2001. — 765 с.;
- S. B. Prusiner. (2012). A Unifying Role for Prions in Neurodegenerative Diseases. Science
.
336, 1511-1513; - V. Beringue, L. Herzog, E. Jaumain, F. Reine, P. Sibille, et. al.. (2012). Facilitated Cross-Species Transmission of Prions in Extraneural Tissue. Science
.
335, 472-475; - Carolina Pola. (2012). Prion escape to spleen. Nat Med
.
18, 360-360; - Элементы: «10 фактов о прионах и амилоидах»;
- Элементы: «Геометрия белковых тел»;
- Charles Weissmann. (2012). Mutation and Selection of Prions. PLoS Pathog
.
8, e1002582.
Забота о здоровье
Еще китайские врачи сообщали, что у пациентов, перенесших COVID-пневмонию, может развиться фиброз легких. Что это такое, чем грозит?
Ольга Богуш: COVID-19 протекает по-разному. У пациентов, которые болели в легкой или скрытой, бессимптомной форме, последствий чаще всего не возникает. Если же больному ставился диагноз двусторонней пневмонии, вызванной коронавирусом, тем более, если было поражено более 25 процентов легких, есть риск возникновения осложнений, в том числе и фиброза.
Что это такое? Фиброз — это замещение нормальной легочной ткани соединительной. В легком, по сути, возникают рубцы. В эластичной ткани формируются нерастяжимые участки, уменьшается дыхательная поверхность легких. Если возникает два-три таких участка и они невелики, пациент этого может и не заметить. Но если фиброз большой, начинаются проблемы с дыханием. Самый частый признак — одышка. Фиброз возникает не только под влиянием вирусной инфекции. Хронической обструктивной болезнью легких, например, страдают многие курильщики со стажем. В тяжелых случаях это приводит к дыхательной недостаточности.
Есть ли возможность предотвратить развитие таких осложнений?
Ольга Богуш: Развитие осложнений зависит от многих причин, от тяжести перенесенного заболевания, в первую очередь. Но бороться за возвращение здоровья легких можно и нужно. В основе лежит физическая реабилитация. Кстати, минздрав недавно выпустил большой документ с рекомендациями по реабилитации после COVID-19.
К сожалению, у нас нет специальных медикаментов, каких-то особых технологий, помогающих легким работать так же, как до болезни. Например, популярный сейчас витамин D от COVID-19 и его последствий не защищает. Легочная ткань должна восстанавливаться сама, а наша задача — ей помочь. Основное, что может сделать человек дома, — заниматься своим физическим восстановлением.
Прежде всего, это дыхательная гимнастика. Она имеет особенности. Нужно выполнять упражнения, направленные на восстановление дыхательной мускулатуры, развивать мышцы, которые отвечают за вдох и выдох.
Дыхательных практик много. Своим пациентам я рекомендую гимнастику Александры Стрельниковой, она очень хорошо работает практически при любых хронических заболеваниях легких. В рекомендациях минздрава указано, что можно практиковать йоговское дыхание. Интересно, что эти дыхательные практики очень отличаются, но на состоянии легких хорошо сказываются и та и другая.
Ну и, конечно, ограничиваться только дыхательными упражнениями можно, пока сохраняется сильная слабость. Гимнастику Стрельниковой, кстати, можно выполнять сначала и сидя, и даже лежа — она все равно работает.
Когда сохраняется сильная слабость, можно даже лежа делать совсем простые вещи: например, надувать шарики или медленно выдыхать через тонкую трубочку, конец которой опущен в воду. Есть специальные тренажеры, которые тренируют вдох-выдох — они красивые, полезные. Хотя и довольно дорогие. Думаю, вполне можно обойтись и без них — просто использовать подручные средства и не лениться. Но постепенно, окрепнув, нужно обязательно добавить физической активности.
Какие упражнения вы рекомендуете?
Ольга Богуш: Обычная гимнастика — это уже хорошо. Если дома есть тренажер — степпер, шаговая дорожка, велосипед — это замечательно. Но даже просто обычная ходьба, махи руками, наклоны туловища и другие элементарные упражнения помогут восстановиться быстрее.
Когда закончится карантинный режим, и можно будет гулять, нужно добавить любую физическую активность на свежем воздухе. Поначалу я бы рекомендовала аэробные нагрузки — неинтенсивные, но продолжительностью не менее получаса-часа.
Самое простое и безопасное — ходьба в бодром темпе, можно велосипед. А интенсивной активностью, подключив силовые упражнения, можно будет заняться позже, когда организм восстановится после болезни.
Какие есть дополнительные рекомендации?
Ольга Богуш: Нужно обратить внимание на сон. Нарушения сна у пациентов мы наблюдаем очень часто.
Многие сейчас психологически насторожены, они элементарно боятся сначала заразиться, потом, если заболели, боятся осложнений. Из-за стресса восстановление замедляется. Важно, чтобы питание было полноценным. Увеличьте количество белка в рационе — это нужно для нормального восстановления тканей организма.
И еще я всем своим пациентам, в том числе и старшего возраста, рекомендую для профилактики сделать вакцинацию против пневмококка. Такая прививка защитит от возникновения вторичной бактериальной пневмонии. Вакцины давно известны. Они проверены временем. Безопасны, и работают очень хорошо.
Часто после перенесенного бронхита или воспаления легких долго держится легкий кашель — прямо месяцами, знаю по себе. Его надо лечить?
Ольга Богуш: Остаточный кашель, действительно, может сохраняться до двух месяцев. Какое-то время может держаться и небольшая температура — в районе 37 градусов, это не страшно.
Иногда пациенты сами затягивают процесс, например, используют ингаляции с муколитиками — лазолваном или какими-то другими аналогичными препаратами. Этого делать не надо. Ингаляции для увлажнения дыхательных путей полезны -с минеральной водой, физраствором. Но если добавлять муколитики, это будет провоцировать кашель.
Поэтому, если какие-то неприятные симптомы со временем не проходят — усиливается одышка, ухудшается самочувствие, кашель приобретает другой характер, к нему присоединяются хрипы, например — в таких случаях не надо лечиться самостоятельно.
Боитесь идти к врачу в поликлинику — сейчас появилась возможность получить консультацию дистанционно, проектов телемедицины сейчас много.
Многие, боясь COVID, купили себе пульсоксиметры. После выздоровления они уже не нужны или могут пригодиться?
Ольга Богуш: Пульсоксиметр поможет контролировать, как проходит восстановление. Нормальный уровень оксигенации — 95-98 единиц, не ниже. 94 — это уже мало, это повод для консультации с врачом. Только надо учесть, что могут быть временные колебания показателей. Например, человек плохо спал — уровень оксигенации у него будет ниже, чем обычно. Так что надо ориентироваться и на общее самочувствие.
Что еще помогает, кроме гимнастики и ингаляций?
Ольга Богуш: Хорошо выполнять вибрационный массаж. Это совсем не сложно: попросите кого-нибудь легко похлопать ладошками по спине несколько минут, аккуратно и не сильно «простукать», «прошлепать» всю спину. Помогает очистить дыхательные пути от слизи, работает как профилактика застойных явлений в легких.
Прионные заболевания человека: симптоматика и перспективы лечения
Механизмы человеческих заболеваний, вызываемых прионами (англ. от Protein («белок») и Infection («Инфекция»); впервые слово было использовано С. Прузинером [1] в конце XX века), до сих пор остаются малоизученными, несмотря на, казалось бы, большой объём исследований, проводимых в данной сфере. Цель настоящей статьи заключается в обобщении и понятном объяснении имеющейся на данной момент информации, касающейся прионов и ассоциированных с ними болезней.
В рамках настоящей статьи приняты следующие сокращения: prion — proteinacious infectious particle; PrP — прионный белок; PrPC — нормальная изоформа прионного белка; PrPSc — инфекционная форма прионного белка; PRNP — ген, кодирующий прионный белок.
Прионные заболевания (также известны как трансмиссивные губчатые энцефалопатии, ТГЭ), ставшие известными человеку в середине XVIII века, являются одним из наиболее интригующих биологических феноменов. Исследования этого явления начались в XX веке с попыток определить биологическую сущность возбудителей сразу нескольких специфичных болезней животных и человека со схожей симптоматикой. Гипотеза об их общей этиологии, выдвинутая в 1960-х годах учёными радиобиологом Т. Альпером и математиком Д. Гриффитом [2] и позже дополненная и доказанная врачом С. Прузинером [3], дала толчок последующим исследованиям в этой области. Однако, несмотря на глубокую заинтересованность научного мира, многие аспекты существования прионов остаются неизученными и по сей день.
К числу человеческих болезней, связанных с этими особыми белковыми инфекционными агентами, относятся болезнь Якоба-Крейтцфельда (CJD) и её различные вариации, фатальная бессоница (FFI/FSI), болезнь Герстмана-Шраусслера-Шейнкера (GSS), куру, вариабельная протеаза-чувствительная прионопатия, и прионное заболевание, связанное с диареей и поражением вегетативной нервной системы.
Все вышеперечисленные прионные болезни на сегодняшний день остаются смертельными, что помещает их в категорию наиболее опасных болезней.
Сущность прионов
После окончания процесса перевода генетической информации, заключённой в виде нуклеотидной последовательности РНК (рибонуклеиновой кислоты), в специфическую последовательность аминокислот, формирующую первичную структуру всех протеинов, новосинтезированные белки сворачиваются в определённые структуры. Прионы — разновидность белковых молекул с неправильной «укладкой» (Рис. 1), дефектная форма нормального мембранного белка PrP, который экспрессируется (проявляется) преимущественно в клетках центральной нервной системы.
Рис. 1. Правильно «сложенный» (слева) и дефектный (справа) белки [4]
Благодаря определённым биологическим машинериям, обычные неправильно сложенные белки легко утилизируются и не оказывают отрицательного эффекта на процессы человеческой жизнедеятельности. Прионы отличаются устойчивостью к этим механизмам и наличием способности превращать нормальные составляющие их белки в себе подобные. Существует две гипотезы, описывающие механизмы этого явления. Согласно первой, гетеродимерной модели (Рис. 2) [5], превращение происходит следующим образом: PrPSc присоединяется к «здоровой» молекуле PrP, и катализирует ряд конформационных изменений, приводящих к её переходу в прионную форму, после чего уже два ненормальных белка расходятся и запускают новые раунды этого процесса. При этом наличие агрегированной («склеенной») формы белка не является обязательной частью прионной трансформации.
Рис. 2. Гетеродимерная модель прионной репликации [6]
Альтернативная гипотеза (Рис. 3) [5] — полимеризационная — гласит, что катализ конформационного превращения нормального белка в патологический может происходить только при «нуклеализации» с последующим образование олигомерных или мультимерных комплексов. Стоит отметить, что последние исследования говорят в пользу второй модели.
Рис. 3. Цикл репликации PrPSc в соответствии с полимеризационной гипотезой [7]
Воздействие PrPSc приводит к этакой «внутриклеточной эпидемии»: образуется множество нефункциональных белковых бляшек на клетках организма, из-за чего он рано или поздно погибает.
Пути возникновения прионных заболеваний
Считается, что существует всего три пути приобретения прионных заболеваний: прямое инфицирование, наследственная передача и спорадическое возникновение по неизвестному механизму [8], но вне зависимости от происхождения они могут быть переданы инфекционным путём.
Был детектирован высоконсервативный ген PRNP, несущий информацию о нормальной изоформе белка PrP, находящийся в p-плече 20-ой хромосомы человека [9]. PRNP имеет протяженность 16 тысяч нуклеотидных последовательностей и содержит 2 экзона. Все наследственные прионные заболевания связаны с аутосомным наследованием мутаций, произошедших в данном гене.
Рис. 4. Локализация гена PRNP в 20-ой хромосоме человека [10].
Основной способ возникновения прионной болезни — спонтанный. Согласно одной из гипотез, объясняющих этот процесс, в нормальных белках происходит определённая посстрансляционная модификация [11]. Иная гипотеза постулирует, что в какой-то конкретный момент неопределённое количество клеток организма соматически (ненаследственно) мутирует и начинает производить дефектный белок PrPSc [12].
Попасть в незаражённый человеческий организм прион может различными путями: при поедании плохоприготовленного мяса, содержащего PrPSc, переливании крови от инфицированного человека к здоровому, трансплантации заражённых органов и тканей.
Клиническая картина прионных заболеваний человека
Ещё одной важной особенностью прионных белков является наличие возможности принимать определённое число различных конформаций. Это обуславливает отличия в течении и симптоматике прионных заболеваний: возможны различные инкубационные периоды, повреждения разных участков коры головного мозга, нарушения различных функций нервной системы [13]. Несмотря на это, среди всех ассоциированных с действием прионов заболеваний прослеживается серия общих чёрт: поражение нервной системы, изначальное отсутствие иммунного ответа на дефектные белки PrP вследствие постоянного присутствия их «правильной» изоформы в организме [5], быстрая прогрессия болезни после окончания инкубационного периода.
Болезнь Крейтцфельда-Якоба (CJD)— редкое, но тем не менее наиболее известное прионное заболевание человека. Существует несколько форм CJD — наследственная, ятрогенная, спорадическая, вариативная, при этом первые три отличаются преимущественно способом распространения. Патоморфологические картины наследственной, ятрогенной и спорадической CJD схожи: во всех случаях наблюдаются прогрессирующие когнитивные нарушения, поражения и дисфункуция мозжечка или комбинация этих расстройств; нарушение зрения вплоть до слепоты; миоклонические припадки. В терминальной стадии появляются глобальные когнитивные нарушения, смерть наступает через 8–10 месяцев после диагностирования CJD [14]. Вариативная CJD имеет несколько более глубоких отличительных особенностей: поражает молодых людей в возрасте в среднем до 30 лет, ее начало характеризуется изменениями поведения, бессонницей, депрессией; двигательные нарушения проявляются примерно через 6 месяцев от начала заболевания в виде прогрессирующей атаксии, хореи, миоклонуса; слабоумие наступает позднее, чем при классической форме, пациент осознает свое ухудшающееся состояние. Для вариабельной БКЯ типичны не только начало в более молодом возрасте, но и средняя выживаемость, превышающая 14 месяцев [15].
Болезнь Герстмана-Штраусслера-Шейнкера (GSS)— заболевание, несколько отличающееся от CJD по нескольким признакам. Эта клиническая форма ТГЭ вызвана мутацией гена PNRP в 102-ом кодоне, приводящей к замене аминокислоты пролин на лейцин [16]. Болезнь начинается в среднем возрасте с проявления мозжечковой атаксии, речевых расстройств, деменции и измнений в поведении. К числу этих симптомов могут прибавляться диплопия, глухота, миоклонические приступы, спастичность.
Куру— прионное заболевание, эндемичное для некоторых районов Папуа-Новой Гвинеи. Основным способом распространения этой болезни был ритуальный каннибализм. Симптоматика включает в себя двигательные расстройства (тремор, массивные фасцикуляции, хореоатетоз, миоклонии). Смерть наступает через приблизительно 2 года после дебюта заболевания. В 2009 году было уставлено, что некоторые члены одного из аборигенных племён обладают врождённым иммунитетом к куру благодаря появлению у них относительно новой полиморфической модификации гена PNRP [17].
Фатальная бессоница — редкое ТГЭ, обычно связанная с наследованием аутосомно-доминантной мутации («семейная», FFI). Отмечается, что существует и спорадическая форма этого заболевания («спонтанная», FSI) [18]. В обоих случаях наблюдается следующая картина: нарушения сна, галлюцинации, вегетативная гиперактивация, двигательные нарушения, резкое и прогрессирующее снижение когнитивных способностей. Болезнь продолжается от 8 до 72 месяцев (среднее значение составляет около 18 месяцев), после чего больной умирает. Происходит стремительная гибель нейронов и астроглиоз переднего и медиального таламуса и нижних оливок с последующим поражением коры головного мозга и мозжечка. Описана стадийность заболевания [18]: начальная форма характеризуется появлением тяжёлой бессонницы, панических атак, патологической тревоги и фобий; на второй стадии развития болезни больной начинает испытывать галлюцинации; на предпоследней стадии больной утрачивает способностью ко сну и стремительно теряет вес; терминальная стадия приводит к утрате речи и смерти.
В 2013 году была обнаружена иная клиническая форма прионных заболеваний, связанная с поражением вегетативной нервной системы [19]. Заболевание ассоциировано с появлением новой мутации в гене PRNP, приводящей к укорочению прионного белка и последующим нарушением его связи с клеточными мембранами. В этом случае распространение прионных агрегатов не ограничивается ЦНС. Предположительно, имеет место миграция PrPSc в переферические нервы и внутренние органы. Серия симптомов проявляется уже в раннем возрасте: хронический понос, вегетативная недостаточность и сенсорная полинейропатия. В зрелом возрасте наступает поражение ЦНС, приводящее к появлению деменции и судорог в числе симптомов.
Вариабельная протеаза-чувствительная прионопатия (VPSPr, ВПЧП) — ещё одно новое редкое спорадическое прионное заболевание, впервые описанное в 2008 году. VPSPr схожа с GSS по особенностям PrPSc, однако в прионе VPSPr не было детектировано каких-либо мутаций гена PRNP [20]. Невосприимчивость прионных белков, вызывающих VPSPr, к действию протеаз, значительно снижена. Болезнь манифестируется расстройствами речи (афазия, дизартрия), когнитивными нарушениями, в некоторых случаях атаксией и паркинсонизмом.
Перспективы лечения прионных заболеваний
Множество исследований в этой области дают основание для возможности ингибиции репликации прионов и лечения вызывамых ими болезней.
Как было отмечено выше, иммунный ответ организма на PrPSc отсутствует. Однако эксперимент, проведённый с полученными in vitro прионами, доказал, что использование антител, выработанных на определённые антигенные детерминанты PrP, индуцирует ингибирование размножения PrPSc [21], приводящее к отсрочке заболевания. Прионное превращение также может быть остановлено с помощью «блокаторов β-структур» — пептидных последовательностей, обогащенных аминокислотой пролином и обладающих гомологичным PrPC составом [5]. Иной подход основан на использовании антисенсовых олигонуклеотидов (АСО) — коротких фрагментов нуклеиновых кислот, останавливающих трансляцию с матричной РНК за счёт образования на ней петлеобразных участков. Именно АСО на данный момент является наиболее эффективным методом ингибиции репликации прионов: эксперименты с введением АСО в спинномозговую жидкость лабораторных мышей, проведённые в Лабораториях Скалистых Гор (Rocky Mountain Laboratories), привели к отсрочке проявления прионных болезней у подопытных на 113–135 дней [22]. Астемизол, относящийся к группе блокаторов H1-гистаминовых рецепторов (H1R), обладает доказанным антиприонным действием [23]. Кроме этого, для предотвращения размножения прионов возможно использование мутаций гена PNRP, приводящих к изменениям Q171R и E219K в аминокислотной последовательности PrP: мутантные прионные белки неспособны переходить в патологическую форму [24].
В данный момент лечение прионных заболеваний может быть только симптоматическим. Использование Брефельдина А, разрущающего аппарат Гольджи и тем самым замедляющего процесс распространения PrPSc и антагонистов NMDA-рецепторов, способствующих более длительному выживанию инфицированных клеток, в терапии CJD не достигло большого успеха [25]. Попытки применения классических противовирусных средств в лечении CJD и GSS также оказались неудачными [25]. Традиционные снотворные обладают нулевой эффективностью в терапии FSI и FFI, хотя был зафиксирован случай отсрочки летального исхода при одновременном использовании ряда сильнодействующих препаратов (диазепама, кетамина, оксида азота) [26]. Терапия VPSPr может быть основана на использовании повышенной чувствительности PrPSc к действию протеаз: доставка в организм смеси специфических иммобилизованных цистеиновых протеаз, вероятно, позволит отсрочить проявление болезни и пролонгировать жизнь больного. Этиотропное лечение основных ТГЭ, судя по всему, должно быть основано на использовании вышеперечисленных или подобных им методов ингибиции прионной репликации.
Литература:
- Stanley B. Prusiner — Autobiography. NobelPrize.org.
- Alper T., Cramp W. A., Haig D. A., Clarke M. C. Does the agent of scrapie replicate without nucleic acid? // Nature. — 1967. — May (vol. 214, no. 5090). — P. 764–766.
- Taubes, Gary. The game of name is fame. But is it science? // Discover. — 1986. — December (т. 7, № 12). — С. 28–41.
- Mayo Foundation of Medical Education and Research.
- И. С. Шкундина, М. Д. Тер-Аванесян. Прионы. Успехи биологической химии, т. 46, 2006. — С. 7–9.
- Nora Whisler. Lecture 34: PRION. — 2015. — P. 22.
- Dipendra Paj Pandeya, Nimish K. Acharya and Seong-Tshool Hong. Review: The Prion and its Potentiality. // Biomedical Research. — 2010.
- Groschup M. H., Kretzschmar H. A., eds. Prion Diseases Diagnosis and Pathogeneis // Archives of Virology — New York: Springer, 2001. — Vol. Suppl 16.
- Oesch B., Westaway D., Wälchli M., et al. A cellular gene encodes scrapie PrP 27–30 protein // Cell. — Cell Press, 1985. — Vol. 40, no. 4. — P. 735–746.
- Andreas Papassotiropoulus, Adriano Aguzzi, M. Axel Wollmer, Christoph Hock. The prion gene is associated with human long-term memory. // Human Molecular Genetics. — 2005.
- Prion Diseases (Transmissible Spongiform Encephalopathies) [Online].
- Prion Clinic: Sporadic Prion Disease [Online].
- Н. Н. Заваденко, Г. Ш. Хондкарян, Р. Ц. Бамбеева, А. А. Холин, Е. Н. Саверская. Прионные заболевания человека: современные аспекты. // Журнал неврологии и психиатрии им. С. С. Корсакова. — 2018. — т. 118, изд. 6. — C. 91–92.
- ICTVdB Index of Viruses. U. S. National Institutes of Health website [Online].
- Clinical and Pathologic Characteristics | Variant Creutzfeldt-Jakob Disease, Classic (CJD) [Online].
- Arata H, Takashima H, Hirano R, et al. Early clinical signs and imaging findings in Gerstmann–Sträussler–Scheinker syndrome (Pro102Leu). // Neurology. — 2006.
- Mead S, Whitfield J, Poulter M, Shah P, Uphill J, Campbell T, Al-Dujaily H, Hummerich H, Beck J, Mein CA, Verzilli C, Whittaker J, Alpers MP, Collinge J. A Novel Protective Prion Protein Variant that Colocalizes with Kuru Exposure. // New England Journal of Medicine. — 2009.
- R. Turner. Dying To Sleep: Fatal Familial Insomnia (FFI) [Online].
- Mead S, Gandhi S, Collinge J, Caine D, Gallujipali D, Carswell Ch, Hyare H, Joiner S, Ayling H, Lashley T, Linehan JM, Al-Doujaily H, Sharps B, Revesz T, Sandberg MK, Reilly MM, Koltzenburg M, Forbes A, Rudge P, Brandner S, Warren JD, Wadsworth JDF, Wood NW, Holton JL, Collinge J. A novel prion disease associated with diarrhea and autonomic neuropathy. // New England Journal of Medicine. — 2013.
- Gambetti P, Puoti G, Zou WQ. Variably protease-sensitive prionopathy: a novel disease of the prion protein. // Journal of Molecular Neuroscience. — 2011.
- M. Enari, E. Flechsig, C. Weissmann. Scrapie prion protein accumulation by scrapie-infected neuroblastoma cells abrogated by exposure to a prion protein antibody. // Proceedings of the National Academy of Sciences. — 2001.
- G. Raymond, et al. Antisense oligonucleotides extend survival of prion-infected mice. // JCI Insight. — 2021.
- Scripps Research Institute Scientists Identify First Potentially Effective Therapy for Human Prion Disease; Unique drug screening approach for prion diseases identifies tacrolimus and astemizole as antiprion agents // Proceedings of the National Academy of Sciences. — 2013.
- K. Kaneko et al. Evidence for protein X binding to a discontinuous epitope on the cellular prion protein during scrapie prion propagation. // Proceedings of the National Academy of Sciences. — 1997.
- M. Maniz, P. Kalakoti, M. Henry, J. Thakur, R. Menger, B. Guthikonda, A. Nanda. Creutzfeldt-Jakob disease: updated diagnostic criteria, treatment algorithm, and the utility of brain biopsy. // Neurosurgical Focus. — 2015.
- Дэвид Робсон. Трагедия людей, переставших спать: можно ли им помочь? [Online] // BBC Future. — 2021.
Лечение прионовых заболеваний
Прионные болезни неизлечимы на данный момент. Врачи не могут повлиять на механизмы развития болезней и даже затормозить их. Продолжительность жизни человека, пораженного прионной инфекцией, зависит от собственных реакций организма.
ВНИМАНИЕ! Средняя продолжительность жизни взрослого пациента с прионной инфекцией составляет от 5 до 7 лет.
Единственное, что могут предложить врачи – кратковременная симптоматическая терапия. По необходимости назначают противосудорожные препараты (если есть эпилептические приступы), гемодиализ при поражении почек при прионной инфекции.
Смертность от прионной инфекции у взрослых – 100%.