Антидепрессанты — одна из самых сложных для фармацевтического консультирования групп препаратов. Нередко связанные с весьма специфическими расстройствами и отпускаемые строго по рецепту, они окутаны множеством тайн и домыслов. Одни пациенты боятся антидепрессантов, другие возлагают на них слишком большие надежды. Но и у первых, и у вторых возникает множество вопросов о том, как эти лекарства повлияют на их жизнь. Эти вопросы они задают не только лечащему врачу, но и другому человеку в белом халате — первостольнику за кассой аптеки. Ответы на самые популярные из них мы собрали в этом материале, чтобы помочь нашим читателям при необходимости выстроить ёмкую и корректную консультацию.
Объясните простым языком — как работают антидепрессанты?
Антидепрессанты — это группа психотропных лекарств, которые влияют на уровень нейромедиаторов (они передают нервные импульсы между клетками в мозге человека), тем самым помогая лечить депрессию. Речь идет о трех гормонах: серотонине, дофамине и норадреналине. Согласно господствующей в научных кругах точке зрения, при депрессии их концентрация заметно снижается, из‑за чего нарушается взаимодействие между нейронами. Современные антидепрессанты помогают обратить этот процесс вспять, вернув мозг к нормальному функционированию. Благодаря этому у пациентов наблюдаются следующие улучшения: повышается настроение, улучшается жизненный тонус, снижаются тревожность и апатия, а также нормализуются сон и аппетит.
Аффективные расстройства
Они же — расстройства настроения
. В МКБ идут под номерами F30 — F39[5]. Включают в себя депрессии, мании и их чередования (БАР, циклотимию и прочее). Общего у этих расстройств, несмотря на кажущиеся различия (кто видел депрессивных и маниакальных больных непременно отметить, насколько различно в них всё — облик, мышление, поведение), довольно много: во-первых, они приводят к тому, что настроение больного становится неадекватным, во-вторых, они имеют сходную фармакологическую природу и, соответственно, лечатся зачастую одними и теми же препаратами, в-третьих, могут «перетекать» из одного в другое (например, то, что было неверно диагностировано как депрессивный эпизод — F32, может на самом деле оказаться БАРом — F31).
Поэтому мы будем рассматривать их все в рамках одного раздела, обращая внимание на различия там, где это необходимо. В рамках этого поста мы рассмотрим депрессию, а другие аффективные расстройства оставим в качестве темы будущих статей.
Депрессия
Пожалуй, самое известное из аффективных расстройств. Как и многие другие термины из психиатрии, слово «депрессия
» нашло довольно широкое применение в разговорном языке[6], где потеряло свою терминологическую точность: «Ах, у меня депрессия, — томно вздыхают барышни, — вчера он ушёл от меня».
Сюрпризом для многих станет тот факт, что абсолютное большинство случаев употребления этого термина в быту — некорректно. Депрессия — это не плохое настроение
, не горе, не подавленность и не усталость. Всё вышеперечисленное может быть симптомами депрессии, но не составляет её сути[7].
Классическое определение депрессии предполагает наличие т.н. «депрессивной триады
»[8]. Первым её компонентом является
ангедония
— снижение способности получать удовольствие: то, что раньше нравилось человеку, перестаёт нравиться и радовать: ни сон, ни еда, ни секс, ни достижения в карьере — ничто не вызывает эмоционального подъёма, ничто не является субъективно значимым и желательным.
Второй компонент — это нарушения мышления
. Это не те нарушения мышления, которые бывают при шизофрении, а свои, специфически депрессивные. Во-первых, в случаях тяжелой депрессии обычно наблюдается снижение темпа мышления. Во-вторых, для депрессии характерны определённые паттерны мышления, определяющие пессимистичность суждений, их самообвиняющий характер.
Третий компонент — это двигательная заторможенность
: больной тяжело, медленно и неохотно двигается.
Следует отметить, что существуют больные, у которых не все компоненты триады явно выражены, но которые, тем не менее, страдают депрессией в той или иной её форме[9]. Лично мне близка позиция Бека, который основным и определяющим компонентом депрессии считает именно когнитивные искажения[10], а все остальные особенности выводит уже из них.
Чем депрессия отличается от горя и других неприятных, но нормальных состояний? Своей неадекватностью. Дело в том, что, само по себе, горе не обязательно является чем-то патологическим, и может быть вполне адекватным ответом на произошедшие события[6]. Например, если у человека умер любимый хомячок, к которому тот был привязан, наличие признаков депрессивной триады в течение нескольких дней после этого события ещё не повод утверждать о том, что он (человек) страдает депрессией.
Однако если со времени неприятного события прошли годы, человек давно завёл нового хомячка, его дочь счастливо вышла замуж и родила внука, самого человека недавно повысили на любимой работе, и он успешно завершил сложный проект, однако все его мысли всё равно крутятся вокруг умершего питомца, он целыми днями занимается самообвинениями и ничто не доставляет ему удовольствия, а вставать утром с постели стало безумно тяжело, то имеет смысл отправить такого человека к специалисту: вполне возможно, у него развилась депрессия.
Хорошее видео о том, что такое депрессия, есть на TED-ED:
Теперь, когда мы определили, что представляет собой депрессия, можно поговорить о её причинах. В рамках этой статьи мы не станем рассматривать психологические аспекты депрессии (об этом — в следующих статьях), а сосредоточимся на биохимии мозга.
Как это часто бывает в психиатрии, единого мнения о том, что же такое депрессия на нейрохимическом уровне, в литературе до сих пор нет[9]. Есть лишь некоторое количество более или менее распространённых гипотез и доказательств в пользу каждой из них.
Исторически первым было предположение о том, что депрессия
напрямую с
вязана с недостатком
определённых
нейромедиаторов
, в частности серотонина и норадреналина[7,9].
Основания для выдвижения этой гипотезы достаточно просты и прозрачны: препараты, которые влияют на обратный захват, релиз или разрушение этих нейромедиаторов, приводят к улучшению состояния, по крайней мере, некоторых депрессивных пациентов.
А препараты, снижающие количество серотонина и норадреналина, наоборот вызывают депрессивные симптомы.
Моноаминовую гипотезу можно наглядно представить в виде следующей картинки, в левой части которой отображается нормальное состояние, а в правой — депрессия (нейромедиатор показан в виде треугольников):
В прошлой статье, когда речь шла о шизофрении, мы говорили, в основном, о дофамине, теперь же речь пойдёт о серотонине
и
норадреналине
.
Начнём с последнего. Итак, у нас в мозге есть норадренергические нейроны, т.е. такие, которые в качестве средства передачи сигнала используют нейромедиатор норадреналин. Основным скоплением таких нейронов в мозге является т.н. голубоватое пятно
(locus coeruleus)[11]:
Оно является частью ретикулярной формации и расположено в стволе мозга на уровне моста. Аксоны его нейронов восходят к верхним слоям коры больших полушарий, гиппокампу, миндалине, перегородке, стриатуму, коре мозжечка. Нисходящие проекции идут в спинной мозг к симпатическим и мотонейронам.
Некоторые из этих проекций (отростков нейронов из голубоватого пятна, тянущихся к другим областям мозга) имеют большое значение в формировании (и лечении) депрессивной симптоматики.
Так, например, одна из проекций в префронтальную кору головного мозга отвечает за регулирование настроения[9]:
Другая — за воздействие норадреналина на внимание:
Проекция в лимбическую систему влияет на эмоции, энергичность, усталость и психомоторную активность:
Проекция в мозжечок может быть ответственна за регуляцию моторной активности и наличие / отсутствие тремора:
Основная функция голубоватого пятна
— определять, на что будет обращено внимание: на внешние стимулы или на внутренние ощущения[9]. Кроме того, оно играет важную роль в процессах познания и контроле настроения. А если мы вспомним, что для депрессии характерно снижение когнитивных и мнестических способностей, ухудшение способности к произвольной концентрации внимания, а также, собственно, неадекватное настроение[8], то станет понятно, почему голубоватое пятно имеет значение в этиологии и лечении депрессии.
У каждого норадренергического нейрона есть рецепторы (чем-то же он должен принимать сигналы от своих собратьев и контролировать собственный релиз нейромедиатора). Эти рецепторы можно поделить, во-первых, на пре-
и
постсинаптические
(в зависимости от расположения), а, во-вторых, на
альфа-
и
бета-
подтипы, которые потом делятся по опосредуемым эффектам, локализации, а также аффинитету к различным веществам на α1-, α2-, β1-, β2, β3-адренорецепторы[9].
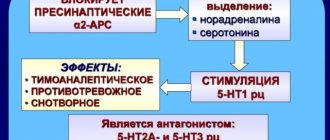
Для нас здесь важным является то, что постсинаптические
α1-, α2-, β1-рецепторы являются основными каналами для передачи сигнала, а
пресинаптические
α2-рецепторы обеспечивают отрицательную обратную связь: когда в синаптической щели норадреналина слишком много, он связывается с этими рецепторами, и нейрон перестаёт релизить этот нейромедиатор[12]. Соответственно (и это важно для лечения), если мы заблокируем этот рецептор антагонистом, то мы таким образом «сломаем тормоз», и количество норадреналина в синаптической щели увеличится. На этом принципе основана работа некоторых антидепрессантов, но об этом — далее.
Разобравшись немного с норадренергической передачей, перейдём к рассмотрению серотонинергической
. Как следует из названия, она имеет отношение к нейронам, использующим в качестве мессенджера
серотонин
. Такие нейроны имеют свои рецепторы, которые тоже можно поделить на пре- и постсинаптические. К первым относятся 5HT1A и 5HT1D. Ко вторым, соответственно, 5HT1A (один и тот же вид рецептора может быть и пре-, и постсинаптическим), 5HT1D, 5HT2A (
привет, психонавты!
), 5HT2C, 5HT3, и 5HT4[9].
Пресинаптические рецепторы, как и в случае норадренергических нейронов, описанных выше, выполняют функцию обеспечения отрицательной обратной связи
: когда серотонина в синаптической щели становится много, его молекула связывается с пресинаптическим рецептором, и нейрон прекращает его выделений и, соответственно, передачу импульса.
Пресинаптические рецепторы 5HT1D и 5HT1A в этом контексте отличаются тем, что первый тормозит релиз серотонина, а второй — прекращает вовсе. Нам это интересно в том контексте, что вещества, являющиеся антагонистами 5HT1D-рецептора, могут способствовать усилению серотонинергической передачи.
Дальше — чудесатее и чудесатее. Серотонинергический нейрон имеет в качестве пресинаптических не только серотонинергические, но и норадринергические рецепторы[9]. Это означает, что концентрация норадреналина влияет на релиз серотонина
. Как и в случае норадринергических нейронов, речь идёт о α2-рецепторах. А это значит, что лекарство, которое блокирует эти рецепторы (их антагонист) будет увеличивать не только норадренергическую, но и серотонинергическую передачу. Так работает, например,
миртазапин
.
Но и это ещё не всё. На поверхности тела серотонинергического нейрона находятся α1-рецепторы (тоже норадренергические), которые работают не как «тормоз», а как «педаль акселератора», обеспечивая положительную обратную свзязь: соединяясь с таким рецептором, молекула норадреналина (или любого другого агониста) усиливает выпуск нейроном серотонина и, соответственно, передачу импульса[12].
Серотонинергические нейроны группируются в стволе мозга: в варолиевом мосту и ядрах шва. Проекции этих нейронов в кору влияют на настроение (т.е. напрямую связаны с рассматриваемыми здесь аффективными расстройствами)[9]:
Проекции в базальные ядра влияют на движения, а также на обсессии и компульсии (именно поэтому антидепрессанты группы СИОЗС применяют для лечения обсессивно-компульсивного расстройства[13]).
Проекции в лимбическую систему связаны с тревожностью и паникой (особую роль в этом играют рецепторы 5HT2A и 5HT2C),
а проекции в гипоталамус — с регуляцией аппетита и пищевого поведения (СИОЗСы используются и для лечения булимии за счет воздействия на рецепторы 5HT3):
Проекции в промежуточный мозг ответственны за бессонницу (которая часто бывает при депрессии), и снова главную роль здесь играют рецепторы 5HT2A:
И, наконец, о грустном: проекции в спинной мозг ответственны за возникновение эректильной дисфункции (частый побочный эффект от приема СИОЗС, наряду со снижением либидо):
Итак, суммируя всё вышесказанное, можно сделать вывод о том, что дефицит серотонина
приведёт к депрессии, тревожности, паническим явлениям, может спровоцировать фобии, обсессии, компульсии и даже вызвать обжорство.
И, наконец, дофамин
. Подробно роль дофамина и дофаминергические путей разобрана в предыдущей части статьи, здесь мы кратко ограничимся описанием роли этого нейромедиатора и соответствующих нейронов в этиологии и лечении депрессии.
Начнем с того, что на сегодняшний день установлена связь депрессии с наличием дефицита дофаминергической передачи, а также, что агонисты (или частичные агонисты) дофаминовых рецепторов могут быть полезны для лечения депрессивных состояний[1]. Существуют свидетельства того, что при депрессии повышается плотность D2-рецепторов[2], что тоже указывает на то, что их агонисты или ингибиторы обратного захвата дофамина могут быть полезны при депрессии. Кроме того, лекарства, повышающие уровень дофаминергической передачи, помогают при апатии и отсутствии энергии[3], а также при абулии, которая тоже характерна для некоторых депрессивных пациентов.
В целом же разбивку нейромедиаторов по эмоциям можно представить в виде вот такой картинки[3]:
А лекарства, используемые для её лечения, соответственно, в виде вот такой[3]:
Тут следует отметить, что моноаминовая гипотеза в настоящее время считается несколько «наивной», и на самом деле там все гораздо сложнее — имеют место сложные процессы регуляции плотности рецепторов и механизмов экспрессии генов, но это всё выходит за рамки нашей статьи. Для понимания основ функционирования антидепрессантов на концептуальном уровне моноаминовой гипотезы вполне достаточно.
Что будет, если по ходу лечения пациент перестает принимать назначенный препарат?
Все зависит от ситуации. Если отмена будет резкой, велик риск, что организм не успеет перестроиться на новый режим, и побочные эффекты кратно возрастут. Это называется синдромом отмены и может выражаться по‑разному. Чаще всего пациенты жалуются на головокружения, головные боли, расстройства сна, спазмы и дрожь в конечностях. Существует также синдром отдачи, при котором несвоевременный отказ от препарата провоцирует возвращение всех негативных симптомов депрессии. При постепенном отказе таких последствий не возникает, поэтому крайне важно придерживаться той схемы приема, которая предписана врачом.
Часть первая, в которой мы смотрим изумленными детскими глазами и ничего вообще не понимаем
К антидепрессантам всегда было много вопросов. В отличие от «обычных» лекарств, умом их не понять, тут надо просто верить. Например, все антидепрессанты начинают действовать только ко второй неделе приема. Традиционно руководства объясняют это тем, что «за это время лекарство накапливается». Но что значит «накапливается»? Ведь препарат либо действует сразу, либо не действует вовсе. Все прочие психотропные вещества действуют практически сразу. Снотворные действуют сразу. Транквилизаторы действуют сразу. Нейролептики, нормотимики, противосудорожные, стимуляторы, — все они начинают действовать быстро. А «упрямые» антидепрессанты — только через две недели. Спрашивается, почему?
Расшифровку некоторых терминов из области психофармакологии см. в Словарике в конце статьи. — Ред.
Рисунок 1. Реклама «Торазина» (торговое название хлорпромазина в США) рекомендует применение препарата при шизофреническом бреде и галлюцинациях.
Антидепрессанты улучшают эмоциональный фон больным с депрессией и никак не влияют на настроение здоровых. Это не нормально. Если вещество обладает психоактивным действием, оно оказывает одинаковое влияние и на патологические процессы, и на физиологические. Если человеку, страдающему бессонницей, дать снотворное — он уснет. А если дать снотворное здоровому — он точно так же уснет. Если тревожному и возбужденному пациенту выдать бензодиазепиновый транквилизатор, то человек успокоится и затихнет. А если обычному человеку? То же самое — человек затихнет и успокоится. «Старые злые» классические нейролептики (тот же хлорпромазин — «Аминазин») до сих пор незаменимы при острых психозах: по сути, на взбунтовавшийся мозг они оказывают действие ковровой бомбардировки, останавливая психическую активность через обрыв дофаминовой передачи.
А если здорового человека связать и наколоть нейролептиками, то с его ментальными процессами произойдет то же самое — мозг превратится в выжженную пустыню. Но с антидепрессантами картина совершенно другая. На депрессивный фон настроения они оказывают действие, но на нормальный — нет. Здоровый человек заработает только побочные эффекты, но никакого изменения сознания. Так откуда таблетка узнает, какой человек находится в депрессии, а какой нет?
Ключевой симптом депрессии — снижение настроения. Само по себе это не проблема: есть масса веществ, быстро и гарантированно поднимающих настроение — например, 40-процентный раствор этилового спирта или психостимуляторы, причем подействуют они не через две недели, а с первой же дозы. Почему же тогда медицина их не использует? Дело в том, что они абсолютно не помогают от депрессии: ни алкоголь, ни амфетамины не обладают антидепрессивным действием, что бы там людская молва не говорила. А антидепрессанты — такие как ингибиторы обратного захвата серотонина «Прозак», «Золофт», «Паксил», «Ципрамил» — помогают. Почему?
Молекулярные основы психозов
С развитием психозов связывают повышение потока дофамина и в меньшей степени — серотонина. Согласно дофаминовой гипотезе шизофрении, антипсихотический эффект нейролептиков объясняется их способностью блокировать дофаминовые рецепторы. Однако, поскольку в мозге существует множество разновидностей этих рецепторов и выполняют они самые разнообразные функции, заглушить их все начисто, как это делают классические нейролептики (аминазин, галоперидол, хлорпротиксен и прочие), нельзя — будет масса неприятных побочных эффектов. Поэтому современные атипичные нейролептики избирательно блокируют некоторые типы дофаминовых и серотониновых рецепторов, и побочных эффектов у них гораздо меньше.
Симптомы депрессии
Основной симптом клинической депрессии (или большого депрессивного расстройства) — стойкое снижение эмоционального фона, не сводящееся к просто «плохому настроению», которое может быть у любого человека. Клиническая депрессия — это болезнь, имеющая четкие критерии и описывающаяся целым букетом симптомов. Депрессия проявляется в снижении настроения, чувстве вины и безнадежности, утрате интересов и удовольствия, снижении энергичности, а в результате в повышенной утомляемости и снижении активности, причем все это должно сохраняться в течение не менее чем двух недель.
Моноаминооксидаза (МАО)
Это фермент, занимающийся разрушением моноаминов (если точнее, — катаболизмом моноаминов путем окислительного дезаминирования). К моноаминам относится масса эндогенных гормонов и нейромедиаторов, в том числе и все интересующие нас: дофамин, адреналин, норадреналин, серотонин и гистамин; а также экзогенных психоактивных веществ (например, фенилэтиламин и происходящие от него наркотические вещества).
МАО — один из ключевых ферментов человеческого мозга, а родственных белков в семействе моноаминовых рецепторов — около сорока. Если заблокировать МАО, моноамины перестанут разрушаться и начнут накапливаться в системе синаптической передачи, что не всегда хорошо. Поэтому даже современные селективные ингибиторы МАО — очень мощные антидепрессивные средства — применять достаточно опасно и разрешается только в условиях стационара, где идет постоянное наблюдение и контроль над состоянием пациента.
Не опасны ли антидепрессанты для организма?
Как и в случае с любыми другими лекарствами, при лечении антидепрессантами могут возникнуть побочные эффекты. Чаще всего речь идет о сонливости (а иногда, напротив, бессоннице), заторможенности реакций, гипотонии. Однако учитывая, что на другой чаше весов зачастую находятся мысли больного об уходе из жизни или причинении себе иного вреда, это не расценивается как серьезная помеха.
Некоторые антидепрессанты противопоказаны при сердечных заболеваниях (аритмии, нарушении проводимости в миокарде), но при этом существуют ЛС, которые разрешено принимать даже людям, перенесшим инфаркт. Ряд таких препаратов нельзя назначать при патологиях почек и печени. Зная об особенностях здоровья пациента, врач подбирает наиболее подходящий для него вариант. Поэтому опасность антидепрессанты могут представлять только при самолечении.
АНТИДЕПРЕССАНТЫ в кардиологической практике
Депрессия и сердечно-сосудистые заболевания тесно взаимосвязаны. В последние годы появились доказательства того, что депрессия является независимым фактором риска ишемической болезни сердца (ИБС). В то же время у части больных ИБС депрессия может развиться вторично, как реакция личности на тяжелое соматическое заболевание. Согласно данным отечественных и зарубежных исследований, распространенность депрессии среди больных ИБС составляет приблизительно 20%.
У больных ИБС депрессия не только отягощает клиническое состояние и затрудняет реабилитацию, но и сокращает продолжительность жизни. Результаты исследований последних лет свидетельствуют о том, что депрессия повышает риск коронарных катастроф и коронарной смерти у больных ИБС. Уровень смертности у пациентов, перенесших ИМ и страдающих депрессией, в 3-6 раз выше, чем у больных, перенесших ИМ и не имеющих признаков депрессии.
Несмотря на широкую распространенность, депрессия у кардиологических больных в большинстве случаев не распознается и не лечится. Это влечет за собой многократные обращения к кардиологу, все новые и новые обследования, причем как больной, так и его лечащий врач оказываются не удовлетворенными результатами лечения. Такая ситуация обусловлена в первую очередь тем, что больные, как правило, не предъявляют собственно депрессивных жалоб, таких, как подавленное настроение и утрата интересов. В клинической картине превалируют хронический болевой синдром (кардиалгия), различные нарушения сна, повышенная утомляемость, снижение активности, нарушение аппетита, изменение веса, снижение работоспособности, проблемы с концентрацией внимания, снижение полового влечения, панические атаки или перманентные вегетативные расстройства. Описанная симптоматика характерна для так называемой соматизированной или скрытой, маскированной депрессии [1].
Определенную роль в гиподиагностике депрессии у кардиологических больных играет тот факт, что кардиологи не в полной мере владеют техникой обследования депрессивных больных. Выявление депрессивных расстройств в значительной степени облегчается при использовании психометрических шкал и тестов, в том числе субъективных (на вопросы отвечает сам больной). Среди субъективных психометрических шкал для скрининга депрессии наиболее известны Госпитальная шкала тревоги и депрессии (A. Zigmond, 1983) и Опросник депрессии Бека (А. Beck, 1961). Многократное применение психометрических шкал позволяет изучить динамику состояния больных на фоне лечения. Учитывая отрицательное влияние депрессии на прогноз, скрининг в целях выявления депрессии целесообразно проводить среди наиболее уязвимых категорий больных ИБС — больных нестабильной стенокардией, лиц, у которых наблюдались острые коронарные синдромы, в том числе ИМ, а также пациентов, перенесших операцию АКШ.
Согласно принятой на сегодня концепции, депрессии легкой и средней степени тяжести у кардиологических больных может лечить кардиолог или врач общей практики. Это стало возможным благодаря появлению в последние годы целого ряда новых высокоэффективных антидепрессантов, не обладающих в отличие от классических трициклических антидепрессантов (амитриптилина и др.) выраженной поведенческой токсичностью и негативным побочным действием на сердечно-сосудистую систему.
Применение трициклических антидепрессантов у кардиологических больных крайне нежелательно из-за соматотропных эффектов этих препаратов, в том числе вследствие их влияния на проводящую систему сердца. Назначение этих препаратов в терапевтических дозах сопровождается удлинением интервалов PQ, QRS и QT, особенно у пациентов с исходными нарушениями проводимости [2]. Было показано, что трициклические антидепрессанты, блокирующие быстрые натриевые каналы, проявляют свойства гуанитидинподобных антиаритмических средств класса IА, которые, по данным ряда исследований, в том числе Cardiac Arrhythmia Suppression Trial (1992), повышают уровень смертности у больных ИБС. Среди побочных эффектов, характерных для трициклических антидепрессантов и значительно ограничивающих их применение в кардиологии, — рефлекторная тахикардия. Результаты широко известного Фремингемского исследования свидетельствуют о том, что у больных с установленной ИБС следует избегать назначения препаратов, повышающих частоту сердечных сокращений (ЧСС), поскольку увеличение ЧСС коррелирует с увеличением смертности у этой категории больных. Очевидно, что трициклические антидепрессанты не стоит также назначать пациентам, у которых высок риск развития ИБС. Еще одним неблагоприятным побочным эффектом трициклических антидепрессантов является ортостатическая гипотония, наиболее выраженная в первые две недели терапии и особенно характерная для пожилых больных. Нельзя не учитывать также и неблагоприятные поведенческие эффекты, возникающие на фоне лечения трициклическими антидепрессантами, — сонливость, снижение уровня внимания, ухудшение памяти, затруднение интеллектуальной деятельности, нарушение тонкой координации движений. Стремясь минимизировать описанные выше побочные эффекты, врачи нередко назначают трициклические антидепрессанты в очень малых дозах (например, 1/4-1/2 таблетки амитриптилина в день), которых недостаточно для получения антидепрессивного эффекта (минимальная терапевтическая доза амитриптилина составляет 2-3 таблетки в сутки). Многочисленные соматотропные и поведенческие эффекты трициклических антидепрессантов связаны с их неселективностью — влиянием на несколько групп рецепторов ЦНС (α1-адренорецепторы, серотониновые, мускариновые и гистаминовые Н1-рецепторы).
В отличие от препаратов первого поколения современные антидепрессанты обладают селективностью и в этой связи лишены многих побочных свойств, характерных для трициклических антидепрессантов.
В число новых антидепрессантов входят:
- селективные ингибиторы обратного захвата серотонина: циталопрам (ципрамил), пароксетин (паксил), флуоксетин (прозак), флувоксамин (феварин), сертралин (золофт);
- селективные стимуляторы обратного захвата серотонина: тианептин (коаксил);
- тетрациклические антидепрессанты: миансерин (леривон);
- селективные ингибиторы обратного захвата серотонина и норадреналина: милнаципран (иксел).
Селективные антидепрессанты обладают достаточно высокой антидепрессивной активностью. По выраженности антидепрессивного действия они несколько уступают классическим трициклическим антидепрессантам, однако превосходят их, когда речь идет о переносимости и безопасности применения. В связи с этим селективные антидепрессанты могут рассматриваться как препараты первого ряда у пациентов с сердечно-сосудистыми заболеваниями, а также у пожилых больных.
Наиболее широко сегодня используются селективные ингибиторы обратного захвата серотонина (СИОЗС). Препараты этой группы тормозят обратное проникновение серотонина из синаптической щели внутрь пресинаптического нейрона и не оказывают существенного влияния на другие нейромедиаторы. Свое название СИОЗС получили из-за большей селективности в отношении блокирования обратного захвата серотонина, чем обратного захвата норадреналина (по меньшей мере в 10 раз). Кроме того, СИОЗС имеют незначительное сродство к α1-адренорецепторам, м-холинорецепторам, гистаминовым Н1-рецепторам, что обеспечивает их хорошую переносимость. СИОЗС в отличие от трициклических антидепрессантов не обладают способностью к блокированию медленных натриевых каналов, в связи с чем они более безопасны при передозировке.
Препараты группы СИОЗС имеют благоприятный кардиальный профиль. Так, в исследовании S. Roose и соавт. [3], изучавших безопасность СИОЗС у больных ИБС с сопутствующей депрессией, было показано, что 7-недельная терапия флуоксетином в дозе 60 мг/сут не вызывала каких-либо кардиальных осложнений, не влияла на уровень артериального давления (АД), проводимость и желудочковую эктопическую активность и сопровождалась статистически достоверным снижением ЧСС на 5 уд/мин. Надо отметить, что 47% больных, включенных в исследование, перенесли ранее ИМ.
У пациентов с сердечно-сосудистыми заболеваниями преимущества СИОЗС особенно отчетливо проявляются в сопоставлении с трициклическими антидепрессантами. Проспективное рандомизированное контролируемое 6-недельное сравнительное исследование пароксетина (в суточной дозе до 40 мг) и нортриптилина у больных ИБС с депрессией, перенесших ИМ не ранее чем за 3 месяца до включения в исследование, наглядно показало преимущества СИОЗС [4]. Терапия пароксетином не сопровождалась статистически значимыми изменениями уровня АД, ЧСС, нарушениями сердечного ритма и проводимости. По причине кардиальных осложнений из исследования досрочно выбыли только один больной из группы пароксетина и 7 больных из группы нортриптилина (всего в исследовании участвовал 81 больной). На фоне нортриптилина было отмечено увеличение средней ЧСС на 11% (с 75 до 83 уд/мин), наблюдалось также статистически значимое увеличение случаев ортостатической гипотонии и нарушений процесса реполяризации миокарда, по данным ЭКГ. При этом препараты были одинаково эффективны в отношении купирования депрессивных нарушений у больных ИБС.
В 1999 году были опубликованы данные исследования Sertraline Antidepressant Heart Attack Trial [5], целью которого было изучение эффективности и безопасности одного из препаратов группы СИОЗС — сертралина — и его влияния на кардиальный профиль у больных с клинически выраженной депрессией, развившейся после ИМ. В исследование были включены больные, перенесшие ИМ (через 5-30 дней после инфаркта) с фракцией выброса 35% и более. 16-недельная терапия сертралином в дозе 50-200 мг/сут не оказала существенного влияния на уровень АД, ЧСС, проводимость миокарда и фракцию выброса левого желудочка.
Хотя все СИОЗС имеют сходный механизм действия, тем не менее отдельные препараты этой группы различаются по химической структуре, а также по степени связывания с несеротониновыми рецепторами ЦНС, то есть по степени селективности. Наибольшей селективностью в группе СИОЗС обладает циталопрам. Высокая селективность препарата обеспечивает его хорошую переносимость и безопасность у наиболее уязвимых групп больных (пожилых пациентов с сердечно-сосудистыми заболеваниями, органическими поражениями ЦНС). Согласно нашим данным, применение циталопрама в терапевтической дозе 20 мг/сут у больных ИБС, перенесших ИМ, не сопровождается кардиотоксическими эффектами — колебаниями АД, ЧСС, нарушениями сердечного ритма и проводимости, в том числе по данным суточного мониторирования ЭКГ. Метаанализ нескольких исследований, в которых приняли участие более 1400 пациентов, получавших циталопрам (30% были в пожилом возрасте), показал, что циталопрам не оказывает значимого влияния на продолжительность интервалов PQ, QRS, QT и процессы реполяризации миокарда [6]. Циталопрам обладает минимальным по сравнению с другими антидепрессантами риском межлекарственных взаимодействий и потому хорошо комбинируется с препаратами, которые регулярно принимают пациенты с сердечно-сосудистыми заболеваниями (β-блокаторами, нитратами, антагонистами кальция, ингибиторами ангиотензинпревращающего фермента, диуретиками).
Для лечения депрессий легкой и средней степени тяжести у кардиологических больных рекомендуются следующие дозы СИОЗС: циталопрам (ципрамил) — 20 мг/сут, пароксетин (паксил) — 20 мг/сут, сертралин (золофт) — 50 мг/сут, флуоксетин (прозак) — 20 мг/сут, флувоксамин (феварин) — 50 мг/сут. Эти дозы являются начальными и в то же время могут рассматриваться как оптимальные терапевтические при депрессиях легкой и средней тяжести. Таким образом, кардиологу или врачу общей практики при назначении СИОЗС в большинстве случаев не требуется проводить титрацию дозы. Важно учитывать некоторую отсроченность клинического эффекта большинства антидепрессантов: выраженный антидепрессивный эффект СИОЗС отмечается к концу первых двух недель терапии. Желательно проинформировать об этом больного, с тем чтобы он не ожидал немедленного положительного эффекта от приема антидепрессанта. В случае недостаточной эффективности указанные выше дозы могут быть увеличены.
Препараты группы СИОЗС обладают не только антидепрессивным, но и противотревожным (анксиолитическим) действием, в связи с чем они эффективны при наличии у больных сопутствующей тревожной симптоматики, при панических атаках, фобических синдромах. Некоторые представители СИОЗС оказывают также мягкое активирующее действие (например, циталопрам, флуоксетин).
Побочные эффекты СИОЗС минимальны, особенно при назначении препаратов в рекомендованных дозах. При применении СИОЗС отмечались побочные эффекты со стороны желудочно-кишечного тракта (сухость во рту, тошнота, диарея), а также сонливость, головные боли, головокружение, тремор, потливость. Эти побочные эффекты возникают редко, как правило, в первые две недели лечения, и редуцируются самостоятельно. В большинстве случаев отмены препарата не требуется.
По клинической эффективности к СИОЗС близок милнаципран (иксел) — селективный ингибитор обратного захвата серотонина и норадреналина. Для этого препарата характерно наряду с антидепрессивным умеренное активирующее действие. Седативный эффект выражен незначительно. Терапевтические дозы милнаципрана для лечения депрессий легкой и средней степени тяжести — 50-100 мг/сут.
Тетрациклический антидепрессант миансерин (леривон) считается «мягким» антидепрессантом. Механизм его действия заключается в блокаде пресинаптических адренорецепторов, препарат блокирует также серотониновые и гистаминовые H1-рецепторы. Миансерин оказывает мягкий антидепрессивный, а также выраженный седативный эффекты. Назначается перед сном в дозе 15-60 мг. В терапевтических дозах антихолинергические побочные эффекты миансерина выражены в меньшей степени, чем у трициклических антидепрессантов.
В последние годы, помимо СИОЗС, в кардиологической практике широко используется тианептин (коаксил). По химической структуре препарат относится к атипическим трициклическим антидепрессантам, а по механизму действия является селективным стимулятором обратного захвата серотонина. Тианептин обладает антидепрессивным, противотревожным и активирующим эффектами, безопасен при терапии депрессий у пожилых людей и больных с сердечно-сосудистой патологией. Препарат не вызывает клинически значимой ортостатической гипотонии, не влияет на уровень АД, ЧСС, уровень сахара в крови и другие гематологические показатели [7]. Тианептин рекомендуется в дозе 37,5 мг/сут (1 таблетка 3 раза в день), при необходимости дозу можно увеличить до 50 мг/сут.
Лечение коморбидной депрессии у кардиологических больных, особенно у больных, перенесших острые коронарные инциденты и операции на сердце, не только приводит к улучшению психического состояния, но и сопровождается положительной динамикой клинического и функционального статуса больных, улучшает качество жизни, сокращает сроки реабилитации и возвращения больных к трудовой деятельности. Следует также предположить, что лечение депрессии у больных ИБС оказывает положительное влияние на прогноз. В настоящее время проводятся два больших исследования — SADHART и ENRICH, видимо, через несколько лет можно будет более определенно ответить на вопрос, способствует ли лечение депрессии после ИМ снижению смертности у больных ИБС?
По вопросам литературы обращайтесь в редакцию
Правда ли, что, однажды начав, препараты от депрессии придется принимать всю жизнь?
Лечение антидепрессантами — дело не быстрое, и длительность его во многом зависит от тяжести состояния человека. Обычно курс приема этих препаратов продолжается не менее полугода. Если по прошествии шести месяцев улучшений не наблюдается, врач может продлить курс или заменить препарат. Поэтому нужно быть готовым к тому, что антидепрессанты придется принимать достаточно долго. Однако, о пожизненном лечении речи не идет: пациент либо начнет выздоравливать, и необходимость в антидепрессантах постепенно отпадет, либо продемонстрирует устойчивость к ним, и врач выберет другую стратегию. Также существует рекомендация ВОЗ, согласно которой антидепрессанты следует принимать еще как минимум 9 месяцев после исчезновения симптомов депрессии.
Гарантирует ли прием антидепрессантов полное излечение от депрессии?
К сожалению, нет. Зачастую причины депрессивных расстройств кроются не в физиологии, а в психологии человека, поэтому лекарственная терапия оказывает лишь временный эффект, который постепенно сходит на нет после отмены препарата. Зная об этом, врачи обычно используют антидепрессанты как часть комплексного лечения, в которое также входят сеансы психотерапии. Впрочем, некоторым пациентам для выздоровления хватает только лекарств. А некоторым они наоборот не помогают. Депрессия — очень сложное расстройство, поэтому для каждого конкретного случая врачи подбирают свои методы лечения.
Влияют ли антидепрессанты на сексуальную жизнь?
Сильные антидепрессанты действительно могут оказывать не очень хорошее влияние на эту деликатную сферу жизни как у мужчин, так и у женщин. Среди побочных действий некоторых трициклических препаратов встречается приапизм — длительная болезненная эрекция, не связанная с половым влечением. Более современные лекарства (ингибиторы МАО) в некоторых случаях приводят к аноргазмии и снижению полового влечения. Такой эффект антидепрессантов считается побочным, встречается далеко не у всех и исчезает при отмене препарата и корректировке лечения. Поэтому о случившихся расстройствах половой сферы нужно незамедлительно сообщать врачу.
Совместимы ли антидепрессанты с алкоголем?
При медикаментозном лечении депрессии употребления спиртного следует избегать. При этом разные группы антидепрессантов взаимодействуют с алкоголем по‑разному. Смешивание со спиртом одних (например, трициклических антидепрессантов) может привести к тяжким последствиям вплоть до летального исхода. Более современные лекарства в этом плане не так опасны. Но ингибиторы МАО, например, могут влиять на сужение сосудов (а значит, опосредованно, и на эрекцию), а также могут усиливать действие крепких напитков и спровоцировать, например, поражение печени или нервной системы. О том, как именно препарат взаимодействует с алкоголем, всегда написано в инструкции. И в большинстве случаев это взаимодействие является нежелательным.
Источники
- Lacasse J.R., Leo J. Serotonin and depression: a disconnect between the advertisements and the scientific literature // Florida State University College of Social Work, Tallahassee, Florida, United States of America PLoS Med. — 2005. — Т. 2, № 12.
- Rosenbaum JF, Fava M, Hoog SL, et al. Selective serotonin reuptake inhibitor discontinuation syndrome: a randomized clinical trial. Biol Psychiatry 1998 // https://www.uptodate.com/contents/discontinuing-antidepressant-medications-in-adults/abstract/17
- Haddad P.M. Antidepressant discontinuation syndromes // Drug Safety journal. — 2001. — Vol. 24, no. 3. — P. 183—197. — PMID 11347722.
- American Psychiatric Association. The Truth About Antidepressants // https://www.psychiatry.org/news-room/apa-blogs/apa-blog/2016/03/the-truth-about-antidepressants
- Тарасенко О. А. Побочное действие антидепрессантов // Провизор. — 2003. — № 14. https://www.provisor.com.ua/archive/2003/N14/art_33.php
- Программа ВОЗ по охране психического здоровья // https://www.who.int/mental_health/mhgap/evidence/depression/q2/ru/
- F Hieronymus et al., Efficacy of selective serotonin reuptake inhibitors in the absence of side effects: a mega-analysis of citalopram and paroxetine in adult depression // Molecular Psychiatry, 2017; doi:10.1038/mp.2017.147
- Rafael Gafoor. Antidepressant utilisation and incidence of weight gain during 10 years’ follow-up: population-based cohort study // BMJ 2018; 361 https://www.bmj.com/content/361/bmj.K1951
- Megan Brooks. Antidepressants Worsen Sexual Dysfunction and Depression? https://www.medscape.com/viewarticle/870660
- Кучер Е. О., Шевчук М. К., Сивак К. В. Экспериментальное исследование влияния алкоголя на биологические эффекты антидепрессантов // Вестник Санкт-петербургского университета. – 2010. – Серия 11, выпуск 1. https://vestnik.spbu.ru/pdf10/s11/s11v1_10_S.pdf
Словарик
Психофармакология раздел медицины, занимающийся психотропными лекарственными средствами. Строго говоря, первыми были препараты лития, появившиеся в 40-е годы. Но общепринятым началом эры психофармакологии считают открытие хлорпромазина (аминазина). Антидепрессанты лекарственные препараты, назначаемые при депрессиях и расстройствах тревожного круга. Самые известные их группы — трициклические антидепрессанты (например, амитриптилин) и селективные ингибиторы обратного захвата серотонина (например, «Прозак»). Амитриптилин самый популярный и знаменитый антидепрессант. Классический представитель группы трициклических антидепрессантов. Используется до сих пор. Флюоксетин («Прозак») первый селективный ингибитор обратного захвата серотонина (СИОЗС). Это имя стало нарицательным и вошло в массовый обиход. Прозак хорош в первую очередь даже не высокой эффективностью (в этом плане старые трициклические антидепрессанты все равно его превосходят), но хорошей переносимостью. СИОЗС сделали доступным лечение для массового амбулаторного пациента. Разумеется, это немедленно привело к множеству перегибов и злоупотреблений. Антипсихотики препараты, обладающие антипсихотической активностью. С оговорками А. можно считать синонимом слова «нейролептик», однако нейролептики — это весьма четко очерченный класс, среди них есть т.н. «малые нейролептики» (они же «корректоры поведения»), которые собственно антипсихотической активностью обладают весьма в умеренной степени. Нейролептики сильнодействующие антипсихотические препараты. Аминазин самый первый и самый знаменитый нейролептик, «золотой стандарт». По силе действия все прочие антипсихотики измеряются в «аминазиновом эквиваленте». Фенотиазин гетероциклическое соединение, производные которого нашли широкое распространение в медицине как нейролептики, антигистаминные и антиаритмические средства. Нормотимики препараты, стабилизирующие эмоциональное состояние и настроение, убирающие перепады настроения и возвращающие поведение к границам нормы (например, препараты лития). Психотропные вещества любые химические соединения, оказывающие влияние на психические процессы. Часто эту фразу используют как синоним наркотиков, но это не совсем верно. Психофармакологические препараты — это психотропные вещества. Кофеин (он же теин) — это тоже психотропное вещество. Стимуляторы вещества с психостимулирующим действием, практически все запрещенные к применению. Классический представитель — амфетамин. Транквилизаторы психотропные лекарственные средства с успокаивающим, тормозящим, подавляющим и снотворным действием. В классическом понимании «большие транквилизаторы» — это нейролептики, но сейчас под транквилизаторами почти всегда понимают «малые транквилизаторы», то есть противотревожные, седативные и снотворные препараты, — в первую очередь, это группа бензодиазепинов (самые популярные среди которых — феназепам и диазепам). Хлордиазепоксид (элениум) первый бензодиазепиновый транквилизатор. В настоящее время практически не применяется, поскольку вытеснен последующими препаратами. Диазепам самый популярный бензодиазепин. Самый популярный транквилизатор и психотропный препарат вообще. Классический безнодиазепиновый транквилизатор, со всеми плюсами и минусами своего класса. Острые психозы быстро развивающиеся нарушения психической деятельности. «Сумасшествие» или «безумие» в обывательском понимании. ГАМК (γ-аминомасляная кислота) основной тормозящий нейромедиатор человека. фМРТ (функциональная магнитно-резонансная томография) сделала возможным исследование активности живой нервной ткани. Внедрение технологий фМРТ определило прогресс нейронауки в последнее десятилетие. Моноаминовая теория действия антидепрессантов предполагает, что их лекарственный эффект достигается за счет специфической блокады определенных рецепторов к моноаминам, — серотонину, норадреналину, дофамину. Нейропластическая модель не перечеркивает моноаминовую, но эволюционно развивает и дополняет ее. Нейропластическая модель одна из гипотез механизмов действия антидепрессантов. Предполагает, что их лекарственный эффект достигается за счет влияния на процессы синаптической пластичности и роста нейрональных окончаний.